Teorie modelů pásů a příklady
teorie pásma je ten, který definuje elektronickou strukturu pevné látky jako celku. Může být aplikován na jakýkoliv typ pevné látky, ale je to v kovech, kde se projevují jeho největší úspěchy. Podle této teorie, kovová vazba vyplývá z elektrostatické přitažlivosti mezi pozitivně nabitými ionty a mobilními elektrony v krystalu..
Proto má kovový krystal "moře elektronů", které může vysvětlit jeho fyzikální vlastnosti. Spodní obrázek znázorňuje kovový spoj. Fialové tečky elektronů jsou delokalizovány v moři, které obklopuje kladně nabité atomy kovu.

“Moře elektronů” je tvořeno od individuálních příspěvků každého atomu kovu. Tyto příspěvky jsou jeho atomové orbitály. Kovové struktury jsou obecně kompaktní; čím kompaktnější jsou, tím větší jsou interakce mezi jejich atomy.
V důsledku toho se jejich atomové orbitály překrývají a vytvářejí velmi úzké molekulární orbity v energii. Moře elektronů je pak jen velká množina molekulárních orbitálů s různým rozsahem energií. Rozsah těchto energií tvoří tzv. Energetické pásy.
Tyto kapely jsou přítomny v jakékoliv oblasti krystalu, což je důvod, proč je považován za celek, a odtud přichází definice této teorie.
Index
- 1 Model energetických pásem
- 1.1 Úroveň Fermi
- 2 Polovodiče
- 2.1 Vnitřní a vnější polovodiče
- 3 Příklady teorie aplikovaného pásma
- 4 Odkazy
Model energetických pásem

Když s orbitál atomu kovu ovlivňuje to jeho souseda (N = 2), dva molekulární orbitals jsou tvořeny: jeden vazby (zelený pás) a jeden anti-link (tmavě červený pruh) \ t.
Pokud N = 3, jsou nyní vytvořeny tři molekulární orbitály, z nichž střední (černý pás) je nezávazný. Pokud N = 4, jsou vytvořeny čtyři orbitály a jeden s největším vazebným charakterem a jeden s největším protimrazovým charakterem jsou dále odděleny.
Rozsah energie dostupné pro molekulární orbitály se rozšiřuje, jak atomy kovu krystalu poskytují jejich orbitály. To má také za následek pokles energetického prostoru mezi orbitály do té míry, že kondenzují v pásmu.
Tato kapela složená z orbitálů má oblasti nízké energie (zelené a žluté barvy) a vysokou energii (barvy oranžové a červené barvy). Jejich energetické extrémy mají nízkou hustotu; nicméně, většina molekulárních orbitals (bílý pruh) být koncentrován ve středu.
To znamená, že elektrony „běžejí rychleji“ středem pásma než na koncích.
Úroveň Fermi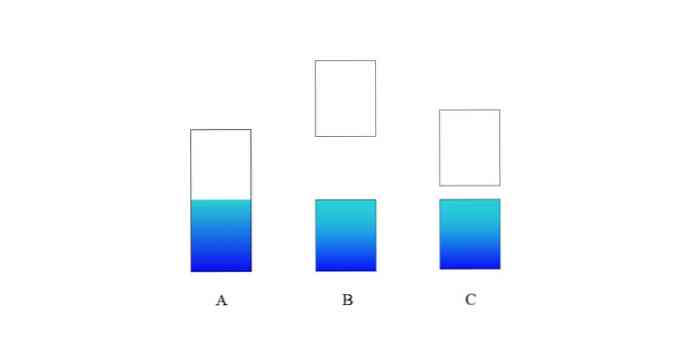
Je to nejvyšší energetický stav obsazený elektrony v pevné látce při absolutní nulové teplotě (T = 0 K).
Jakmile je kapela postavena, elektrony začnou zabírat všechny své molekulární orbitály. Pokud má kov jeden valenční elektron (y)1), všechny elektrony v jeho krystalu zabírají polovinu pásma.
Druhá neobsazená polovina je známá jako hnací skupina, zatímco skupina plná elektronů se nazývá valenční skupina.
V horním obrázku A představuje typický valenční pás (modrý) a vodivý pás (bílý) pro kov. Namodralá hraniční čára označuje úroveň Fermi.
Protože kovy mají také p-orbitály, kombinují se stejným způsobem, aby vznikly p-pásmo (bílé).
V případě kovů jsou pásy s a p velmi blízko energie. To umožňuje jejich přesahy, což podporuje elektrony z valenčního pásma do vodivého pásma. K tomu dochází i při teplotách mírně nad 0 K.
Pro přechodové kovy a od období 4 směrem dolů je také možné vytvořit pásy z.
Pro určení elektrických vlastností je velmi důležitá úroveň Fermi vzhledem k vodivému pásmu.
Například kov Z s úrovní Fermi velmi blízko vodivostního pásma (nejbližší prázdný pás v energii) má vyšší elektrickou vodivost než kov X, ve kterém je jeho úroveň Fermi daleko od tohoto pásma..
Polovodiče
Elektrická vodivost pak spočívá v migraci elektronů z valenčního pásma do vodivého pásma.
Pokud je energetická mezera mezi oběma pásy velmi velká, máme izolační těleso (jako u B). Na druhé straně, pokud je tato mezera relativně malá, je pevnou látkou polovodič (v případě C).
Tváří v tvář nárůstu teploty získávají elektrony ve valenčním pásmu dostatek energie k migraci směrem k vodivému pásmu. To má za následek elektrický proud.
Ve skutečnosti se jedná o kvalitu pevných nebo polovodičových materiálů: při pokojové teplotě jsou izolátory, ale při vysokých teplotách jsou vodiče..
Vnitřní a vnější polovodiče

Vnitřní vodiče jsou takové, ve kterých je energetická mezera mezi valenčním pásmem a vodivým pásem dostatečně malá, takže tepelná energie umožňuje průchod elektronů..
Na druhé straně vnější vodiče vykazují změny ve svých elektronických strukturách po dotování nečistotami, které zvyšují jejich elektrickou vodivost. Tato nečistota může být další kov nebo nekovový prvek.
Jestliže nečistota má více valenčních elektronů, může poskytnout donorový pás, který slouží jako můstek pro elektrony valenčního pásma pro přechod do vodivého pásma. Tyto pevné látky jsou polovodiče typu n. Zde n pochází z "negativní".
V horním obrázku je pruh dárce znázorněn v modrém bloku těsně pod pásmem řízení (Typ n).
Na druhé straně, pokud má nečistota méně valenčních elektronů, poskytuje akceptorové pásmo, které zkracuje energetickou mezeru mezi valenčním pásmem a hnacím pásmem..
Elektrony nejprve migrují k tomuto pásmu a zanechávají za sebou „pozitivní otvory“, které se pohybují opačným směrem.
Jelikož tyto pozitivní mezery označují průchod elektronů, pevnou látkou nebo materiálem je polovodič typu p..
Příklady teorie aplikovaného pásma
- Vysvětlete, proč jsou kovy jasné: jejich mobilní elektrony mohou absorbovat záření v širokém spektru vlnových délek, když skočí na vyšší energetické hladiny. Pak vyzařují světlo a vracejí se na nižší úroveň pásma.
- Krystalický křemík je nejdůležitější polovodičový materiál. Pokud je část křemíku dopována stopami prvku skupiny 13 (B, Al, Ga, In, Tl), stává se polovodičem typu p. Zatímco pokud je dopován prvkem skupiny 15 (N, P, As, Sb, Bi), stává se polovodičem typu n.
- Světelná dioda (LED) je spojovací polovodič p-n. Co tím myslíš? Že materiál má oba typy polovodičů, oba n a p. Elektrony migrují z vodivého pásma polovodiče n-typu, do valenčního pásma polovodiče typu p.
Odkazy
- Whitten, Davis, Peck & Stanley. Chemie (8. vydání). CENGAGE Learning, str. 486-490.
- Shiver a Atkins. (2008). Anorganická chemie (Čtvrté vydání, str. 103-107, 633-635). Mc Graw Hill.
- Loď C. R. (2016). Kapela teorie pevných látek. Získáno dne 28. dubna 2018, z: hyperphysics.phy-astr.gsu.edu
- Steve Kornic (2011). Jít z dluhopisů do kapel z pohledu chemiků. Získáno dne 28. dubna 2018, z: chembio.uoguelph.ca
- Wikipedia. (2018). Vnější polovodič. Získáno dne 28. dubna 2018, z: en.wikipedia.org
- BYJU'S. (2018). Pásová teorie kovů. Získáno dne 28. dubna 2018, z: byjus.com



