Vzorec Sulfát sodný, Vlastnosti, Struktura, Aplikace
síran sodný (disodná sůl kyseliny sírové, tetraoxidosulfát sodný, síran sodný, sůl Glauberu, pakardit, mirabilit) je anorganická sloučenina vzorce Na2SO4 a jeho příbuzné hydráty. Všechny formy jsou bílé pevné látky, které jsou vysoce rozpustné ve vodě.
Je považován za jeden z hlavních chemických produktů prodávaných na trhu. Jeho celosvětová produkce (téměř výhradně ve formě dekahydrátu) činí přibližně 6 milionů tun ročně.

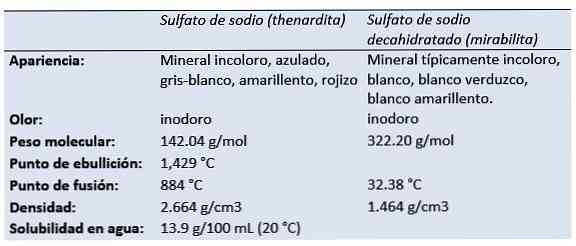
Thenardite je bezvodý minerál síranu sodného, který se vyrábí v suchých odpařovacích prostředích, v suchých jeskyních, ve starých důlních provozech jako výkvět a jako ložisko kolem fumarolů.
To bylo nejprve popsáno v 1825 v Salinas Espartinas (Ciempozuelos, Madrid, Španělsko) a byl jmenován thenardita na počest francouzského chemika Louise Jacques Thénard (1777-1826).

Holandský / německý chemik a lékárník Johann Rudolf Glauber (1604-1670) objevil v roce 1625 ve vodě rakouského pramene dekahydrát síranu sodného (později známý jako Glauberova sůl). Nazval ji mirabilis solí (zázračnou solí), díky svým léčivým vlastnostem.
Mezi lety 1650 a 1660 začal Glauber vyrábět síran sodný z běžné soli (NaCl) a koncentrované kyseliny sírové. Tento proces je považován za začátek chemického průmyslu.
Jeho krystaly byly používány jako projímadlo až do 20. století.
V osmnáctém století, reakce Glauberovy soli s potash (uhličitanem draslíku) začal být používán v průmyslové výrobě limonády (uhličitan sodný) \ t.

V současné době se používá především pro výrobu detergentů a v procesu Kraft pro výrobu papírenské buničiny (dominantní metoda při výrobě papíru).
Ložiska minerálů síranů sodného se nacházejí ve Spojených státech, Kanadě, Španělsku, Itálii, Turecku, Rumunsku, Mexiku, Botswaně, Číně, Egyptě, Mongolsku a Jižní Africe..
Hlavními producenty jsou Čína (provincie Jiangsu a Sichuan), za nimi následuje Španělsko, kde se nachází největší glauberitové ložisko na světě (Cerezo de Río Tirón, Burgos).
Celková světová produkce přírodního síranu sodného se odhaduje na přibližně 8 milionů tun, a to jako vedlejší produkt jiných průmyslových procesů mezi 2 a 4 miliony tun..
Ve Španělsku, podle informací zveřejněných v Národním inventáři zdrojů síranu sodného a dalších aktualizovaných údajů, odhadované zásoby minerálů síranu sodného v řádu 730 Mt katalogizovány jako "rezervy", a 300 Mt více katalogizované jako "jiné zdroje".
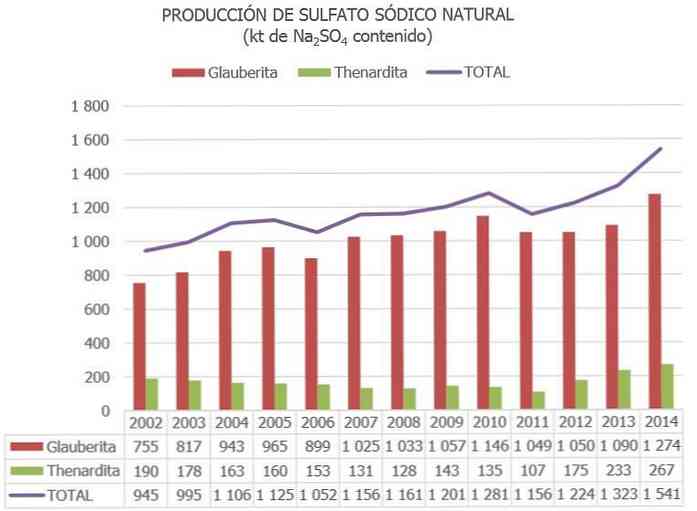
V Evropské unii je Španělsko v současné době jedinou zemí s rudami síranu sodného (převážně Thenardite, Glauberite a Mirabilite)..
V současné době dochází k všeobecnému poklesu poptávky po síranu sodném v textilním sektoru.
V posledních letech došlo v některých regionech k určitému růstu i v jiných odvětvích, jako jsou detergenty, a to díky nízké ceně surovin.
Hlavní rostoucí trhy s detergenty na bázi síranu sodného se nacházejí v Asii, Střední Americe a Jižní Americe.
Vzorce

2D struktura
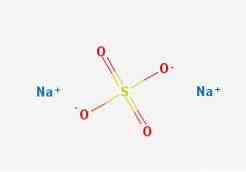
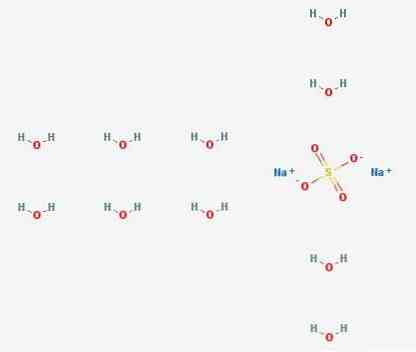
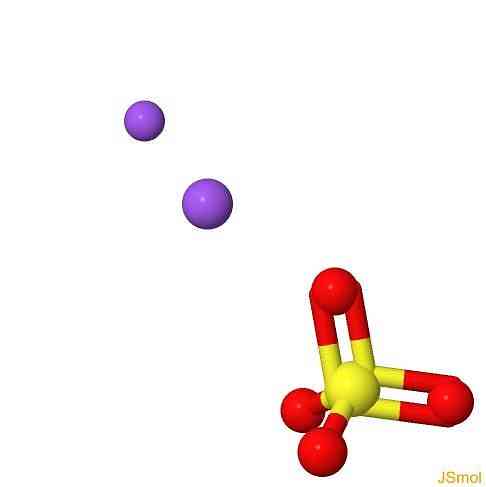
3D struktura
Vlastnosti
Fyzikální a chemické vlastnosti
Síran sodný patří do reaktivní skupiny sodných sloučenin a také patří do skupiny sulfátů, hydrogensíranů a disulfitů..
Hořlavost
Je to nehořlavá látka. Neexistuje riziko exploze jeho prášků.
Reaktivita
Síran sodný je velmi rozpustný ve vodě a hygroskopický. Je velmi stabilní, nereaguje s většinou oxidačních nebo redukčních činidel za normálních teplot. Při vysokých teplotách může být karbotermickou redukcí přeměněn na sulfid sodný.
Chemicky nereaktivní látky jsou považovány za nereaktivní za typických podmínek prostředí (i když mohou reagovat v relativně extrémních podmínkách nebo při katalýze). Jsou odolné vůči oxidaci a redukci (kromě extrémních podmínek).
Nebezpečné chemické reakce
Když se hliník roztaví spolu se síranem sodným nebo draselným, dojde k prudkému výbuchu.
Toxicita
Chemicky nereaktivní látky jsou považovány za netoxické (i když plynné látky z této skupiny mohou působit jako asfyxanty).
Ačkoli síran sodný je obecně považován za netoxický, musí se s ním zacházet opatrně. Prášek může způsobit astma nebo dočasné podráždění očí. Tomuto riziku se lze vyhnout použitím ochrany očí a papírové masky.
Použití
Jeho hlavní aplikace jsou při výrobě:
- prací prášek.
- papírenská buničina.
- textilie.
- sklo.
- syntéza enzymů (výroba vína).
- potravy pro zvířata a zvířata.
- lékárenské výrobky.
- základní chemie obecně.
- oceli.
- Prací prášek
Síran sodný je velmi levný materiál. Jeho největší využití je jako plnivo v pracích prostředcích pro domácnost, spotřebovává cca. 50% světové produkce. Nové kompaktní nebo kapalné detergenty neobsahují síran sodný, takže toto použití se snižuje.
Další použití síranu sodného, který se snižuje, zejména v USA. a Kanada, je v procesu Kraft pro výrobu buničiny. Pokroky v tepelné účinnosti procesu výrazně snížily potřebu síranu sodného.
Sklářský průmysl představuje další důležitou aplikaci pro síran sodný. Je to druhá největší aplikace v Evropě. Síran sodný se používá k odstranění malých vzduchových bublin z roztaveného skla.
V Japonsku je největší aplikace síranu sodného ve výrobě textilií. Síran sodný pomáhá barvivům pronikat rovnoměrně do vláken a nekoroduje nádoby z nerezové oceli používané při barvení (na rozdíl od chloridu sodného, což je alternativní metoda).
Síran sodný je obzvláště vhodný pro skladování nízkoteplotního slunečního tepla (pro pozdější uvolnění v topných aplikacích) v důsledku jeho vysoké akumulační kapacity během fázové přeměny z pevné na kapalnou, která je dána při 32 ° C.
Pro chladicí aplikace snižuje směs s běžnou solí chloridu sodného (NaCl) teplotu tání na 18 ° C.
V laboratoři se bezvodý síran sodný široce používá jako inertní sušící činidlo, aby se odstranily stopy vody z organických roztoků. Jeho působení je pomalejší než působení síranu hořečnatého, ale může být použito s různými materiály, protože je chemicky zcela inertní.
Dekahydrát síranu sodného (Glauberova sůl) byl historicky používán jako projímadlo. Je účinný při eliminaci některých léků, jako je acetaminophen (acetaminophen) z těla po předávkování.
Mezi další aplikace síranu sodného patří jeho použití jako přísady při výrobě osvěžovačů koberců, jako přísady do krmiv pro hospodářská zvířata a při výrobě škrobu..
Klinické účinky
Pro své terapeutické aplikace patří síran sodný do kategorie solných a katarálních laxativ používaných při léčbě zácpy.
Solné katétry jsou soli, které zadržují tekutiny ve střevě osmotickým působením neabsorbované soli, což vede ke zvýšení peristaltiky nepřímo.
Solné katétry jsou špatně absorbovány gastrointestinálním traktem, proto je systémová toxicita nepravděpodobná, pokud nebylo použito obrovské množství. Velké expozice však mohou způsobit dehydrataci a změny elektrolytů sekundární k osmotickým účinkům sloučeniny.
Chronické laxativní zneužívání může nastat u pacientů s poruchami příjmu potravy, Munchausenovým syndromem nebo faktografickými poruchami. Obecně platí, že pacienti pociťují nevolnost, zvracení a průjem související s křečemi v břiše. Závažné účinky mohou zahrnovat dehydrataci, hypotenzi, hypernatrémii a abnormality elektrolytů.
Bezpečnost a rizika
Údaje o nebezpečnosti globálně harmonizovaného systému klasifikace a označování chemických látek (SGA) \ t.
Globálně harmonizovaný systém klasifikace a označování chemikálií (SGA) je mezinárodně dohodnutý systém, který vytvořila OSN a jehož cílem je nahradit různé klasifikační a označovací normy používané v různých zemích pomocí konzistentních globálních kritérií (Organizace spojených národů). Spojené, 2015).
Třídy nebezpečnosti (a jejich odpovídající kapitola GHS), normy pro klasifikaci a označování a doporučení pro síran sodný jsou následující (Evropská agentura pro chemické látky, 2017, Spojené národy, 2015, PubChem, 2017):
Třídy nebezpečnosti GHS
H315: Způsobuje podráždění kůže [Varování Poleptání / podráždění kůže - Kategorie 2].
H317: Může vyvolat alergickou kožní reakci [Varování, senzibilizace, kůže - Kategorie 1].
H319: Způsobuje vážné podráždění očí [Upozornění Vážné poškození očí / podráždění očí - Kategorie 2A].
H412: Zdraví škodlivý pro vodní organismy s dlouhodobými nepříznivými účinky [Nebezpečný pro vodní prostředí, dlouhodobé nebezpečí - Kategorie 3] \ t.
(PubChem, 2017)
Kódy obezřetnostních rad
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 a P501.
Odkazy
- ChemIDplus (2017) 3D struktura 7757-82-6 - bezvodý síran sodný [image]. Zdroj: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D struktura 7727-73-3 - Síran sodný [USP] [image]. Zdroj: chem.nlm.nih.gov.
- Dyet, D. (2007) Thenardite Síran sodný v blízkosti Sodaville Mineral County Nevada [image] Zdroj: en.wikipedia.org.
- Evropská agentura pro chemické látky (ECHA), (2017). Shrnutí klasifikace a označení. Harmonizovaná klasifikace - příloha VI nařízení (ES) č. 1272/2008 (nařízení CLP). Síran sodný.
- Grumetisho (2012) Mirabilita [image] Zdroj: es.wikipedia.org.
- Datová banka nebezpečných látek (HSDB). TOXNET (2017). Síran sodný Bethesda, MD, EU: Národní knihovna medicíny. Zdroj: toxnet.nlm.nih.gov.
- Geologický a hornický institut ve Španělsku (IGME) (2016). GLAUBERITA-THENARDITA (NATURAL SODIUM SULPHATE) 2014. Hornické panorama. Zdroj: igme.es.
- Národní institut pro bezpečnost práce (INSHT). (2010). Mezinárodní bezpečnostní chemické záznamy. Síran sodný. Ministerstvo práce a bezpečnosti. Madrid ES Zdroj: insht.es.
- Langbein Rise (2008) Kontinuální kraft pulp mil [image] Zdroj: wikimedia.org.
- Organizace spojených národů (2015). Globálně harmonizovaný systém klasifikace a označování chemických výrobků (SGA) Šesté revidované vydání. New York, Spojené státy americké: Publikace Organizace spojených národů. Zdroj: unece.org.
- Národní centrum pro biotechnologické informace. PubChem Compound Database (2016) síran sodný - PubChem Struktura [image] Bethesda, MD, EU: Národní knihovna medicíny. Zdroj: pubchem.ncbi.nlm.nih.gov.
- Národní centrum pro biotechnologické informace. PubChem Compound Database (2016) síran sodný - PubChem Struktura [image] Bethesda, MD, EU: Národní knihovna medicíny.
- Národní centrum pro biotechnologické informace. PubChem složená databáze. (2017). Dehydrát síranu sodného. Bethesda, MD, EU: Národní knihovna medicíny. Zdroj: pubchem.ncbi.nlm.nih.gov.
- Národní centrum pro biotechnologické informace. PubChem složená databáze. (2017). Síran sodný Bethesda, MD, EU: Národní knihovna medicíny. Zdroj: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Síran sodný [image] Zdroj: wikimedia.org.
- Wikipedia (2017) Kraft proces. Zdroj: wikipedia.org.
- Wikipedia (2017) Mirabilita. Zdroj: wikipedia.org.
- Wikipedia (2017) Mirabilite. Zdroj: wikipedia.org.
- Wikipedia (2017) Síran sodný. Zdroj: wikipedia.org.
- Wikipedia (2017) Solfato di sodný dekahydrát. Zdroj: https://it.wikipedia.org.
- Wikipedia (2017) Síran sodný. Zdroj: wikipedia.org.
- Wikipedia (2017) Thenardita. Zdroj: wikipedia.org.
- Wikipedia (2017) Thenardite. Zdroj: .wikipedia.org.


