Struktura, vlastnosti, syntéza a použití cyklohexenu
cyklohexenu "Alken" je alkenový nebo cyklický olefin, jehož molekulový vzorec je C6H10. Skládá se z bezbarvé kapaliny, nerozpustné ve vodě a mísitelné s mnoha organickými rozpouštědly. Vyznačuje se hořlavostí a v přírodě se obvykle nachází v uhelném dehtu..
Cyklohexen se syntetizuje částečnou hydrogenací benzenu a dehydratací alkoholového cyklohexanolu; to je, více rezavé formě. Podobně jako ostatní cykloalkeny prochází reakcí elektrofilního přídavku a volnými radikály; například halogenační reakce.
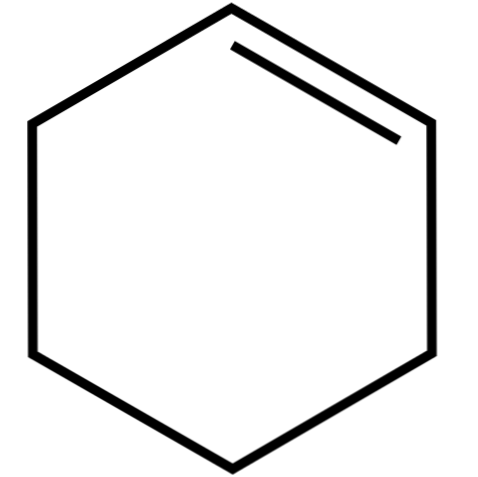
Tento cyklický alken (vrchní obraz) tvoří azeotropní směsi (nerozdělitelné destilací) s nižšími alkoholy a kyselinou octovou. V dlouhodobém skladování není příliš stabilní, protože se rozkládá působením slunečního záření a ultrafialového záření.
Cyklohexen se používá jako rozpouštědlo, a proto má mnoho aplikací, jako jsou: stabilizátor vysokooktanových benzinů a extrakce olejů.
Nejdůležitější však je, že cyklohexen slouží jako meziprodukt a surovina pro výrobu mnoha užitečných sloučenin, mezi které patří: cyklohexanon, kyselina adipová, kyselina maleinová, cyklohexan, butadien, kyselina cyklohexylkarboxylová atd..
Index
- 1 Struktura cyklohexenu
- 1.1 Intermolekulární interakce
- 2 Vlastnosti
- 2.1 Chemické názvy
- 2.2 Molekulová hmotnost
- 2.3 Fyzický vzhled
- 2.4 Vůně
- 2.5 Bod varu
- 2.6 Teplota tání
- 2.7 Bod vzplanutí
- 2.8 Rozpustnost ve vodě
- 2.9 Rozpustnost v organických rozpouštědlech
- 2.10 Hustota
- 2.11 Hustota par
- 2.12 Tlak par
- 2.13 Automatické zapalování
- 2.14 Rozklad
- 2.15 Viskozita
- 2.16 Teplo spalování
- 2.17 Teplo odpařování
- 2.18 Povrchové napětí
- 2.19 Polymerizace
- 2.20 Prahová hodnota zápachu
- 2.21 Index lomu
- 2,22 pH
- 2.23 Stabilita
- 2.24 Reakce
- 3 Shrnutí
- 4 Použití
- 5 Rizika
- 6 Odkazy
Struktura cyklohexenu
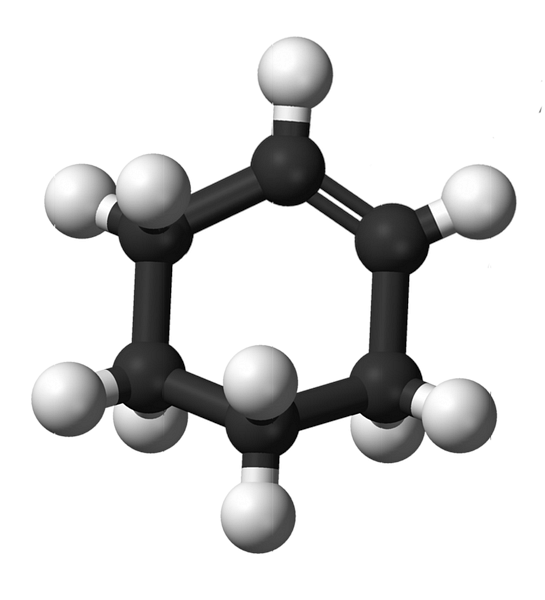
Struktura cyklohexenu s modelem koulí a tyčí je znázorněna na obrázku výše. Je možné si všimnout šesti uhlíkových kruhů a dvojné vazby, obě nenasycenosti sloučeniny. Z tohoto pohledu se zdá, že prsten je plochý; ale není to vůbec.
U startérů mají uhlíky dvojné vazby sp hybridizaci2, což jim dává trigonální geometrii rovin. Tyto dva uhlíky a ty, které k nim přiléhají, jsou proto ve stejné rovině; zatímco dva uhlíky na opačném konci (k dvojné vazbě) jsou nad a pod uvedenou rovinou.
Dolní obrázek dokonale ilustruje, co bylo právě vysvětleno.

Všimněte si, že černý pruh se skládá ze čtyř uhlíků: dvou dvojných vazeb a dalších sousedních. Exponovaná perspektiva je ta, která by byla získána, kdyby divák umístil oko přímo před dvojitou vazbu. Je vidět, že uhlík je nad a pod touto rovinou.
Vzhledem k tomu, že molekula cyklohexenu není statická, oba uhlíky se vymění: jeden bude nižší, zatímco druhý bude stoupat nad rovinu. Takže byste očekávali, že se tato molekula bude chovat.
Intermolekulární interakce
Cyklohexen je uhlovodík, a proto jsou jeho intermolekulární interakce založeny na disperzních silách v Londýně.
Je to proto, že molekula je nepolární, bez trvalého dipólového momentu a její molekulová hmotnost je faktorem, který nejvíce přispívá k udržení koheze v tekutině..
Dvojitá vazba také zvyšuje stupeň interakce, protože se nemůže pohybovat se stejnou flexibilitou jako ostatní uhlíky, což podporuje interakci mezi sousedními molekulami. Z tohoto důvodu má cyklohexen mírně vyšší bod varu (83 ° C) než cyklohexan (81 ° C)..
Vlastnosti
Chemické názvy
Cyklohexen, tetrahydrobenzen.
Molekulová hmotnost
82,146 g / mol.
Fyzický vzhled
Bezbarvá kapalina.
Vůně
Sladká vůně.
Bod varu
83 ° C až 760 mmHg.
Teplota tání
-103,5 ° C.
Bod zapálení
-7 ° C (uzavřený kelímek).
Rozpustnost ve vodě
Prakticky nerozpustný (213 mg / l).
Rozpustnost v organických rozpouštědlech
Mísitelný s ethanolem, benzenem, tetrachlormethanem, petroletherem a acetonem. Očekává se, že bude schopna rozpustit nepolární sloučeniny, jako některé z alotrop uhlí.
Hustota
0,810 g / cm3 při 20 ° C.
Hustota par
2,8 (vzhledem ke vzduchu, který je roven 1).
Tlak páry
89 mmHg při 25 ° C.
Automatické zapalování
244 ° C.
Rozklad
Rozkládá se v přítomnosti solí uranu, působením slunečního záření a ultrafialového záření.
Viskozita
0,625 mPascal při 25 ° C.
Teplo spalování
3,751,7 kJ / mol při 25 ° C.
Odpařovací teplo
30,46 kJ / mol při 25 ° C.
Povrchové napětí
26,26 mN / m.
Polymerizace
Za určitých podmínek může polymerovat.
Prahová hodnota zápachu
0,6 mg / m3.
Index lomu
1,4465 při 20 ° C.
pH
7-8 při 20 ° C.
Stabilita
Cyklohexen není během dlouhodobého skladování příliš stabilní. Vystavení účinkům světla a vzduchu může způsobit tvorbu peroxidů. Podobně je nekompatibilní se silnými oxidačními činidly.
Reakce
-Cykloalkeny se setkávají především s adičními reakcemi, jak elektrofilními, tak volnými radikály.
-Reakce s bromem za vzniku 1,2-dibromcyklohexanu.
-Rychle oxiduje v přítomnosti manganistanu draselného (KMnO)4).
-Je schopna produkovat epoxid (cyklohexen oxid) v přítomnosti kyseliny peroxybenzoové.
Syntéza
Cyklohexen se vyrábí kyslou katalýzou cyklohexanolu:
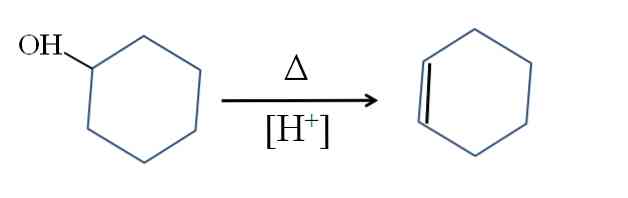
Symbol A představuje teplo potřebné pro podporu výstupu OH skupiny jako molekuly vody v kyselém prostředí (-OH2+).
Cyklohexen se také vyrábí částečnou hydrogenací benzenu; dvě dvojné vazby přidávají molekulu vodíku:
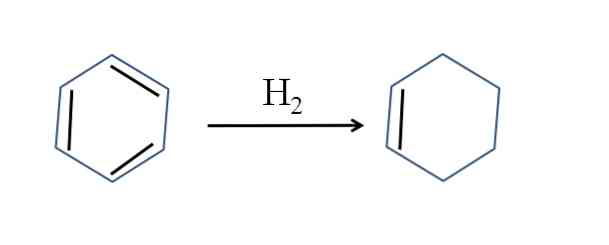
Ačkoliv se reakce jeví jako jednoduchá, vyžaduje velký tlak H2 a katalyzátory.
Použití
-Je použitelný jako organické rozpouštědlo. Kromě toho je to surovina pro výrobu kyseliny adipové, aldehydu kyseliny adipové, kyseliny maleinové, kyseliny cyklohexanu a kyseliny cyklohexylkarboxylové..
-Používá se při výrobě cyklohexanchloridu, sloučeniny používané jako prostředník při výrobě farmaceutických výrobků a přísad do gumy..
-Cyklohexen se také používá při syntéze cyklohexanonu, suroviny pro výrobu léčiv, pesticidů, parfémů a barviv..
-Cyklohexen se podílí na syntéze aminocyklohexanolu, sloučeniny, která se používá jako povrchově aktivní látka a emulgátor..
-Kromě toho může být cyklohexen použit pro přípravu v laboratoři butadienu. Tato sloučenina se používá při výrobě syntetického kaučuku, při výrobě pneumatik pro automobily a také při výrobě akrylových plastů..
-Cyklohexen je surovina pro syntézu lysinu, fenolu, polycykloolefinové pryskyřice a přísad do kaučuku.
-Používá se jako stabilizátor vysokooktanových benzinů.
-Podílí se na syntéze vodotěsných nátěrů, fólií odolných proti trhlinám a pojivových pojiv pro nátěry.
Rizika
Cyklohexen není velmi toxická sloučenina, ale může způsobit zčervenání kůže a očí kontaktem. Jeho inhalace může způsobit kašel a ospalost. Kromě toho může požití způsobit ospalost, potíže s dýcháním a nevolnost.
Cyklohexen se špatně vstřebává v gastrointestinálním traktu, takže při požití se neočekávají žádné závažné systémové účinky. Největší komplikací je její aspirace dýchací soustavou, která může vyvolat chemickou pneumonii.
Odkazy
- Joseph F. Chiang a Simon Harvey Bauer. (1968). Molekulární struktura cyklohexenu. J. Am., Chem. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyklohexen: nebezpečí, syntéza a struktura. Studie. Zdroj: study.com
- Morrison, R. T. a Boyd, R. N. (1987). Organická chemie (5)ta Vydání.). Editorial Addison-Wesley Iberoamericana.
- PubChem. (2019). Cyklohexen. Zdroj: pubchem.ncbi.nlm.nih.gov
- Chemická kniha. (2019). Cyklohexen. Zdroj: chemicalbook.com
- Toxikologická datová síť. (2017). Cyklohexen. Toxnet Zdroj: toxnet.nlm.nih.gov
- Chemoxy. (s.f.). Strukturní vzorec pro cyklohexen je. Zdroj: chemoxy.com


