Typy ketonů, vlastnosti, názvosloví, použití a příklady
ketony jsou to organické sloučeniny, které mají karbonylovou skupinu (-CO). Jsou to jednoduché sloučeniny, ve kterých je uhlík karbonylové skupiny vázán na dva atomy uhlíku (a jejich substituční řetězce). Ketony jsou "jednoduché", protože nemají reaktivní skupiny jako -OH nebo -Cl připojené k uhlíku.
Konečně, eliminace ketonů z lidského těla je obvykle spojena s nízkou hladinou cukru (v diabetických případech a / nebo extrémním hladovění), což může pacientovi způsobit vážné zdravotní problémy..
Index
- 1 Obecný vzorec ketonů
- 2 Typy ketonů
- 2.1 Podle struktury vašeho řetězce
- 2.2 Podle symetrie radikálů
- 2.3 Podle nasycení jeho radikálů
- 2.4 Dicetony
- 3 Fyzikální a chemické vlastnosti ketonů
- 3.1 Bod varu
- 3.2 Rozpustnost
- 3.3 Kyselina
- 3.4 Reaktivita
- 4 Nomenklatura
- 5 Rozdíl mezi aldehydy a ketony
- 6 Průmyslový a každodenní život
- 7 Příklady ketonů
- 7.1 Butanon (C4H8O)
- 7.2 Cyklohexanon (C6H10O)
- 7.3 Testosteron (C19H22O2)
- 7.4 Progesteron (C21H30O2)
- 8 Odkazy
Obecný vzorec ketonů
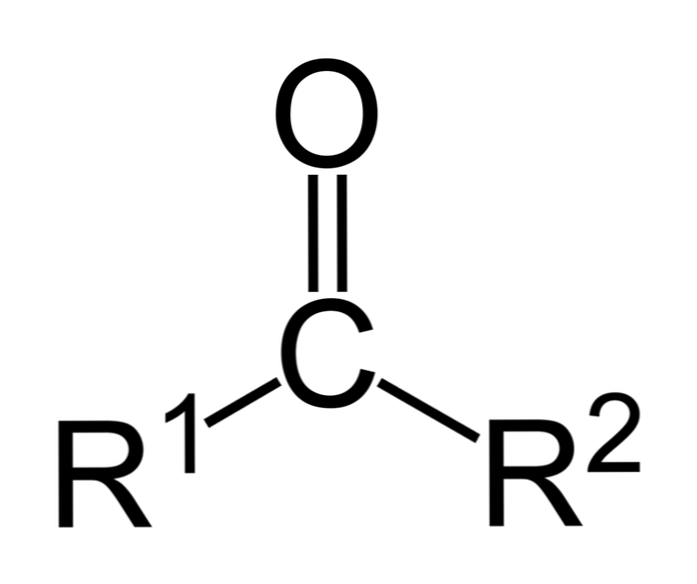
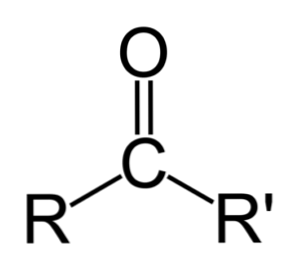
Ketony jsou karbonylové sloučeniny, ve kterých je tato skupina vázána na dvě uhlovodíkové skupiny; tyto mohou být alkylové skupiny, benzenové kruhové skupiny nebo obojí.
Keton může být jednoduše reprezentován jako R- (C = O) -R ', kde R a R' jsou jakékoliv dva uhlovodíkové řetězce (alkany, alkeny, alkyny, cykloalkany, benzenové deriváty a další). K karbonylové skupině nejsou připojeny žádné ketony s vodíkem.
Existuje celá řada metod pro přípravu ketonů v průmyslovém a laboratorním prostředí; Kromě toho je důležité poznamenat, že ketony mohou být syntetizovány různými organismy, včetně lidí.
V průmyslu, nejvíce obyčejný způsob syntézy ketones zahrnuje oxidaci uhlovodíků, typicky s použitím vzduchu. V malém měřítku se ketony obvykle připravují oxidací sekundárních alkoholů, které poskytují jako produkty keton a vodu.
Kromě těchto nejběžnějších metod mohou být ketony syntetizovány prostřednictvím alkenů, alkynů, solí dusíkatých sloučenin, esterů a mnoha dalších sloučenin, což usnadňuje jejich získání..
Typy ketonů
Existuje několik klasifikací ketonů, zejména v závislosti na substituentech v jejich řetězcích R. Níže jsou uvedeny nejběžnější klasifikace těchto látek:
Podle struktury vašeho řetězce
V tomto případě je keton klasifikován způsobem, jakým je strukturován jeho řetězec: alifatické ketony jsou ty, které mají dva radikály R a R ', které mají formu alkylových radikálů (alkanů, alkenů, alkynů a cykloalkanů).
Pro jeho část, aromatics jsou ti to tvořit benzen deriváty, zatímco ještě být ketony. Konečně smíšené ketony jsou takové, které mají R alkylový radikál a R 'arylový radikál nebo naopak.
Podle symetrie jeho radikálů
V tomto případě se studují substituenty R a R 'karbonylové skupiny; pokud jsou stejné (identické), keton se nazývá symetrický; ale když oni jsou různí (jako většina ketones), toto je voláno asymetrické.
Podle nasycení jeho radikálů
Ketony mohou být také klasifikovány podle nasycení svých uhlíkových řetězců; Pokud jsou tyto sloučeniny ve formě alkanů, pak se keton nazývá nasycený keton. Naproti tomu, pokud jsou řetězce nalezeny jako alkény nebo alkiny, pak se keton nazývá nenasycený keton.
Dicetony
Jedná se o samostatnou skupinu ketonů, protože řetězce tohoto ketonu mají ve své struktuře dvě karbonylové skupiny. Některé z těchto ketonů mají jedinečné vlastnosti, jako je delší délka vazby mezi uhlíky.
Například diketony odvozené od cyklohexanu jsou známé jako chinony, které jsou pouze dvě: ortho-benzochinon a para-benzochinon.
Fyzikální a chemické vlastnosti ketonů
Ketony, stejně jako většina aldehydů, jsou kapalné molekuly a mají řadu fyzikálních a chemických vlastností, které se liší v závislosti na délce jejich řetězců. Jeho vlastnosti jsou popsány níže:
Bod varu
Ketony jsou vysoce těkavé, vysoce polární a nemohou darovat vodíky pro vodíkové vazby (nemají atomy vodíku připojené ke své karbonylové skupině), takže mají vyšší teploty varu než alkenes a ethery, ale nižší než ty alkoholy se stejnou molekulovou hmotností.
Teplota varu ketonu se zvyšuje s rostoucí velikostí molekuly. To je způsobeno zásahem van der Waalsových sil a sil dipólu a dipólu, které vyžadují větší množství energie k oddělení atomů a elektronů přitahovaných k molekule..
Rozpustnost
Rozpustnost ketonů má silný vliv částečně na schopnost těchto molekul přijímat atomy vodíku v atomu kyslíku a tak tvořit vodíkovou vazbu s vodou. Kromě toho se mezi ketony a vodou tvoří atraktivní, rozptylové a dipólové a dipólové síly, které zvyšují jejich rozpustný účinek.
Ketony ztrácejí kapacitu rozpustnosti, tím větší je jejich molekula, protože začínají vyžadovat více energie k rozpuštění ve vodě. Jsou také rozpustné v organických sloučeninách.
Kyslost
Díky své karbonylové skupině mají ketony kyselý charakter; toto se děje kvůli kapacitě rezonanční stabilizace této funkční skupiny, která může přenášet protony z jeho dvojné vazby za vzniku konjugované báze zvané enol.
Reaktivita
Ketony jsou součástí velkého počtu organických reakcí; toto nastane kvůli citlivosti jeho karbonylového uhlíku k nukleophilic přidání, kromě polarity tohoto.
Jak bylo uvedeno výše, vysoká reaktivita ketonů z nich činí uznávaný meziprodukt, který slouží jako základ pro syntézu dalších sloučenin.
Nomenklatura
Ketony jsou pojmenovány podle priority nebo důležitosti karbonylové skupiny v celé molekule, takže když máte molekulu řízenou karbonylovou skupinou, je keton pojmenován přidáním přípony „-one“ ke jménu uhlovodíku..
Nejdelší řetězec s karbonylovou skupinou je považován za hlavní řetězec a molekula je pojmenována. Jestliže karbonylová skupina nemá přednost před ostatními funkčními skupinami molekuly, pak je identifikována s "-oxo".
Pro komplikovanější ketony může být poloha funkční skupiny identifikována číslem, a v případě diketonů (ketony se dvěma identickými substituenty R a R ') je pojmenována molekula s příponou "-dione"..
Konečně, slovo "keton" může být také použito po identifikaci řetězců radikálů připojených k karbonylové funkční skupině.
Rozdíl mezi aldehydy a ketony
Největší rozdíl mezi aldehydy a ketony je přítomnost atomu vodíku připojeného k karbonylové skupině v aldehydech.
Tento atom má důležitý účinek, pokud jde o zapojení molekuly do oxidační reakce: aldehyd vytvoří karboxylovou kyselinu nebo sůl karboxylové kyseliny v závislosti na tom, zda k oxidaci dochází za kyselých nebo bazických podmínek..
Na rozdíl od toho keton nemá tento vodík, takže se nevyskytují minimální kroky nezbytné pro oxidaci.
Existují metody oxidace ketonu (s oxidačními činidly mnohem silnějšími než ty, které se obvykle používají), ale tyto molekuly rozbijí molekulu ketonu, přičemž se nejprve rozdělí na dvě nebo více částí..
Průmyslový a každodenní život
V průmyslu jsou ketony často pozorovány v parfémech a barvách, přičemž mají roli stabilizátorů a konzervačních látek, které zabraňují degradaci ostatních složek směsi; mají také široké spektrum rozpouštědel v průmyslových odvětvích, která kromě léčiv vyrábějí výbušniny, barvy a textil.
Aceton (nejmenší a nejjednodušší keton) je celosvětově uznávané rozpouštědlo a používá se jako odstraňovač barev a ředidlo..
V přírodě se ketony mohou objevit jako cukry, nazývané ketózy. Ketózy jsou monosacharidy, které obsahují jeden keton na molekulu. Nejznámější ketose je fruktóza, cukr nalezený v ovoci a medu.
Biosyntéza mastných kyselin, ke které dochází v cytoplazmě živočišných buněk, se také vyskytuje působením ketonů. Konečně, a jak je uvedeno výše, může dojít ke zvýšení ketonů v krvi po hladovění nebo v diabetických případech.
Příklady ketonů
Butanon (C4H)8O)
Tato kapalina, známá také jako MEK (nebo MEC), se vyrábí ve velkém měřítku v průmyslu a používá se jako rozpouštědlo.
Cyklohexanon (C6H10O)
Tento keton se vyrábí v masivním měřítku a používá se jako prekurzor syntetického nylonového materiálu.
Testosteron (C19H22O2)
Je to hlavní hormon mužského pohlaví a anabolický steroid, který se nachází ve většině obratlovců.
Progesteron (C21H30O2)
Endogenní steroidy a pohlavní hormony zapojené do menstruačního cyklu, těhotenství a embryogeneze u lidí a jiných druhů.
Odkazy
- Wikipedia. (s.f.). Keton Zdroj: en.wikipedia.org
- Britannica, E. (s.f.). Keton Získáno z britannica.com
- University, M. S. (s.f.). Aldehydy a ketony. Zdroj: chemistry.msu.edu
- ChemGuide. (s.f.). Představujeme aldehydy a ketony. Zdroj: chemguide.co.uk
- Calgary, U. O. (s.f.). Ketony. Zdroj: chem.ucalgary.ca


