Giemsa barvící základ, materiály, technika a použití
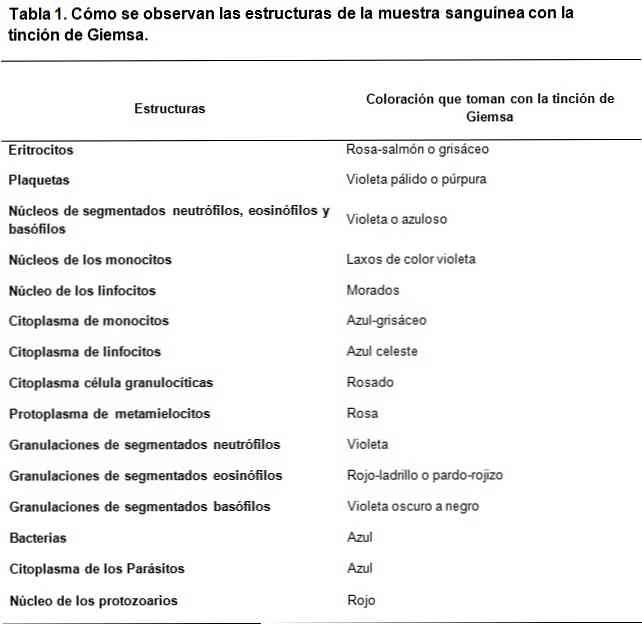
Barvy Giemsa je typ barvení klinických vzorků, založený na směsi kyselých a zásaditých barviv. Jeho tvorba byla inspirována prací Romanowského, kde ji Gustav Giemsa, chemik a bakteriolog původem z Německa, zdokonalil přidáním glycerolu ke stabilizaci sloučenin..
Změny vytvořené v původní technice Romanowského umožnily značně zlepšit mikroskopická pozorování, proto byla technika pokřtěna jménem Giemsa skvrny.
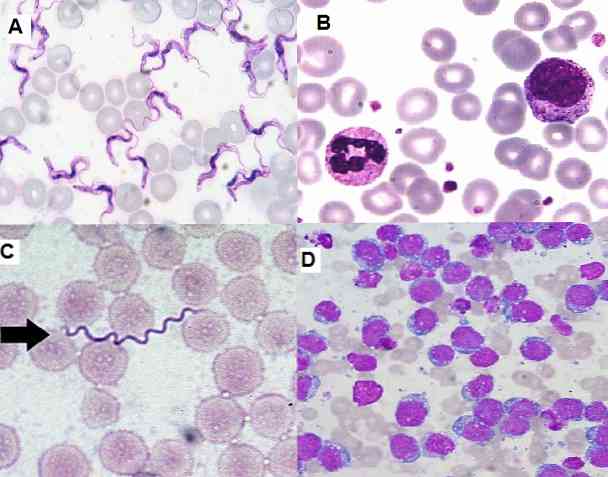
Protože se jedná o jednoduchou techniku, která je vysoce funkční a ekonomická, je v současné době široce používána v klinické laboratoři pro hematologické stěrky, vzorky kostní dřeně a tkáňové řezy..
Technika barvení Giemsa je velmi užitečná pro cytologické studie, protože umožňuje pozorování specifických struktur buněk. Tato technika obarví cytoplazmy, jádra, jádra, vakuoly a granule buněk a dokáže rozlišit i jemné stopy chromatinu.
Kromě toho mohou být detekovány významné změny ve velikosti, tvaru nebo zbarvení jádra, kde je možné vizualizovat ztrátu vztahu nukleus-cytoplazma.
Na druhé straně umožňuje identifikovat nezralé buňky v kostní dřeni a v periferní krvi, což je důležité pro diagnostiku závažných onemocnění, jako je leukémie. Je také možné detekovat mimo jiné hemoparazity, extra a intracelulární bakterie, houby.
V cytogenetice se používá poměrně dobře, protože je možné studovat mitózu buněk.
Index
- 1 Založení zbarvení Giemsa
- 2 Materiály
- 2.1 Materiály pro přípravu matečného roztoku
- 2.2 Způsob přípravy mateřského roztoku
- 2.3 Materiály pro přípravu pufrového roztoku
- 2.4 Konečná příprava barviva
- 2.5 Dodatečné materiály potřebné k provedení barvení
- 3 Technika
- 3.1 Proces barvení
- 4 Nástroje
- 4.1 Hematologie
- 4.2 Mykologie
- 4.3 Bakteriologie
- 4.4 Parazitologie
- 4.5 Cytologie
- 4.6 Cytogenetika
- 5 Výzkum demonstrující účinnost barvení Giemsa
- 6 Doporučení pro dobré barvení
- 7 Běžné chyby ve zbarvení Giemsy
- 7.1 Extrémně modré zbarvení
- 7.2 Nadměrně růžové zabarvení
- 7.3 Přítomnost sraženin v nátěru
- 7.4 Přítomnost morfologických artefaktů
- 8 Režim ukládání
- 9 Odkazy
Založení zbarvení Giemsa
Barvy typu Romanowsky jsou založeny na použití kontrastu mezi kyselými a zásaditými barvivy, aby se dosáhlo zbarvení bazických a kyselých struktur. Jak je vidět, existuje afinita kyselých barviv k barvení základních struktur a naopak.
Použité základní barvivo je methylenová modř a jeho oxidované deriváty (Azure A a Azure B), zatímco kyselé barvivo je eosin.
Kyselinové struktury buněk jsou mimo jiné nukleové kyseliny, granule segmentovaných bazofilů, proto budou barveny methylenovou modří..
V tomto smyslu jsou základní struktury buněk hemoglobin a některé granule, jako například ty, které jsou obsaženy v segmentovaných eozinofilech; tyto budou barveny eosinem.
Na druhé straně, vzhledem k tomu, že methylenová modř a azurová jsou charakterizovány metachromatickými barvivy, mohou poskytovat různý tón různým strukturám podle zatížení polyanionů, které mají..
Strategická kombinace základních a kyselých barviv je schopna vyvinout široké spektrum barev podle biochemických charakteristik každé struktury, které procházejí světle modrými, tmavě modrými, fialovými a fialovými tóny v případě kyselých struktur..
Zatímco zbarvení poskytované eosinem je stabilnější, vytváří barvy mezi červeno-oranžovou a lososovou.
Materiály
Materiály pro přípravu matečného roztoku
Příprava zásobního roztoku vyžaduje navážení 600 mg práškového barviva Giemsa, měřeno 500 cm3 methylalkoholu neobsahujícího aceton a 50 ml neutrálního glycerinu..
Způsob přípravy mateřského roztoku
Umístěte těžký prášek Giemsa do malty. Pokud jsou hrudky, měly by být stříkány. Následně přidejte značné množství změřeného glycerinu a velmi dobře promíchejte. Získaná směs se nalije do velmi čisté jantarové láhve.
Zbytek glycerinu se umístí do malty. Opět se smíchá, aby se vyčistilo zbývající barvivo, které bylo nalepeno na stěnách malty, a nalijte do stejné láhve.
Láhev se přikryje a nechá se 2 hodiny ve vodní lázni při teplotě 55 ° C. Zatímco v lázni bain-marie lehce promíchejte směs každou půlhodinu.
Následně se směs nechá vychladnout, aby se umístil alkohol. Dříve byla část měřeného alkoholu umístěna do malty, aby se dokončilo promývání zbývajícího barviva a pak se přidala ke směsi spolu se zbytkem alkoholu..
Tento přípravek by měl být ponechán zrát nejméně 2 týdny. Část matečného roztoku musí být přefiltrována.
Aby se zabránilo kontaminaci přípravku, doporučuje se projít část, která bude v neustálém používání, na malou jantarovou láhev s kapátkem. Nabijte pokaždé, když dojde k vyčerpání činidla.
Materiály pro přípravu pufrového roztoku
Na druhé straně se připraví roztok pufru při pH 7,2 následujícím způsobem:
Naváží se 6,77 g bezvodého fosforečnanu sodného (NaHPO)4), 2,59 g dihydrogenfosforečnanu draselného (KH)2PO4) a destilovanou vodu do 1000 cm3.
Konečná příprava barviva
Pro přípravu konečného barvicího roztoku se měří 2 cm3 přefiltrovaného zásobního roztoku a smísí se se 6 cm3 pufrového roztoku. Směs se míchá.
Důležitou skutečností, kterou je třeba vzít v úvahu, je to, že techniky přípravy barviva se mohou měnit podle komerčního domu.
Další materiály potřebné k provedení zbarvení
Kromě popsaných materiálů by měla být opatřena barevnými můstky, vodními clonami nebo pufrem pro praní, listy pro předměty nebo kryty, stopkami pro kontrolu doby barvení a papíry pro vysušení nebo materiálem, který lze použít k sušení ( gáza nebo bavlna).
Technika
Proces barvení
1) Před zbarvením musí být vzorek nanesen na čisté podložní sklíčko..
Vzorky mohou být krev, kostní dřeň, řezy histologických tkání nebo cerviko-vaginální vzorky. Doporučuje se, aby byly vnější strany tenké a před zbarvením měly 1 až 2 hodiny sušení.
2) Všechny listy, které musíte zbarvit, jsou umístěny na barevném můstku. Vždy pracujte ve stejném pořadí a každý list dobře identifikujte.
3) Na stěrku naneste několik kapek 100% methanolu (methanolu) a nechte po dobu 3 až 5 minut, aby se vzorek fixoval a dehydratoval..
4) Zlikvidujte methanol přítomný v listu a nechte uschnout na vzduchu.
5) Po zaschnutí umístěte finální barvicí roztok kapátkem, dokud nebude celý list zakryt. Nechte působit 15 minut. Někteří autoři doporučují do 25 min. Záleží na komerčním domě.
6) Vypusťte barvivo a omyjte stěr destilovanou vodou nebo roztokem 7.2 pufru.
7) Na papíře, na kterém se schne, nechte listy uschnout na čerstvém vzduchu, uspořádané svisle pomocí podpěry.
8) Otřete zadní stranu sklíčka gázou nebo vatovým tamponem navlhčeným alkoholem, aby se odstranilo zbývající zbarvení.
Nástroje
Technika barvení Giemsa se používá v několika oblastech: hematologie, mykologie, bakteriologie, parazitologie, cytologie a cytogenetika.
Hematologie
Je to nejčastější nástroj, který je tomuto barvení věnován. S ním můžeme identifikovat každou z buněk přítomných ve vzorcích kostní dřeně nebo periferní krve. Kromě odhadu počtu každé série, která je schopna detekovat leukocytózu nebo leukopenii, trombocytopenii atd..
Vzhledem k tomu, že je citlivá na identifikaci nezralých buněk, je důležitá při diagnostice akutních nebo chronických leukémií. Je také možné diagnostikovat anémii, jako je srpkovitá nemoc, srpkovité onemocnění, mezi jinými..
Mykologie
V této oblasti je běžně používáno k vyhledávání Histoplasma capsulatum (intracelulární dimorfní houba) ve vzorcích tkáně.
Bakteriologie
U hematologických skvrn obarvených Giemsou je možné detekovat Borrelias sp u pacientů, kteří mají onemocnění zvané rekurentní horečka. Ve vzorcích odebraných ve febrilním vrcholu jsou mezi erytrocyty hojné spirochety.
Je také možné vizualizovat intracelulární bakterie jako Rickettsias sp a Chlamydia trachomatis v infikovaných buňkách.
Parazitologie
V oblasti parazitologie umožnilo barvení Giemsa diagnostiku parazitárních onemocnění, jako je malárie, Chagasova choroba a leishmanióza..
V prvních dvou parazitech Plasmodium sp a Trypanosoma cruzi mohou být zobrazeny v periferní krvi infikovaných pacientů, mohou být nalezeny v různých stadiích podle fáze, ve které je nemoc.
Pro zlepšení vyhledávání krevních parazitů se doporučuje použít barvivo Giemsa smíšené s barvivem May-Grünwald.
Podobně může být diagnostikována kožní leishmanióza při hodnocení vzorků kožních biopsií obarvených Giemsou, kde je nalezen parazit..
Cytologie
Barvení Giemsa se také používá pro cytologické studie endocervikálních vzorků, i když pro tento účel nejde o nejčastěji používanou techniku..
Ale v případech nedostatku zdrojů mohou být použity, které mají podobnou funkcionalitu, jakou nabízí technika Papanicolaou a za nižší náklady. Vyžaduje však odborné znalosti ze strany zkoušejícího.
Cytogenetika
Významným rysem barvení Giemsa je jeho schopnost silně se vázat na oblasti bohaté na adeniny DNA a tyminy. To umožňuje vizualizaci DNA během mitózy buněk v různých stavech kondenzace.
Tyto studie jsou nezbytné pro detekci chromatických aberací, jako jsou duplikace, delece nebo translokace různých oblastí chromosomů..
Výzkum demonstrující účinnost barvení Giemsa
Cannova et al (2016) srovnávali 3 techniky barvení pro diagnostiku kožní leishmaniózy.
K tomu použili vzorky získané z pokusného zvířete (Mesocrisetus auratus) experimentálně inokulován Leishmanias.
Autoři prokázali, že barvení Giemsa bylo lepší než barvení Pap-mart® a Gaffney. Proto se domnívali, že barvivo Giemsa je ideální pro diagnostiku kožní leishmaniózy.
Vynikající výsledky získané autory jsou dány skutečností, že kombinace barviv, které tvoří směs Giemsa, představuje nezbytné podmínky pro vytvoření příznivého kontrastu, což umožňuje jasně odlišit struktury amastigotu, a to jak uvnitř, tak extracelulárně..
Ostatní techniky (Pap-mart® a Gaffney) to také udělaly, ale slabším způsobem, a proto je obtížnější je vizualizovat. Proto se pro parazitologickou diagnózu leishmaniózy doporučuje barvení Giemsa.
Stejně tak studie Ramíreza a kol. (1994) hodnotila platnost Giemsových a Lendrumových skvrn v nátěrech spojivek pro identifikaci Chlamydia trachomatis.
Autoři zjistili, že barvení Giemsa a Ledrum má stejnou specificitu, ale Giemsa byl citlivější.
To vysvětluje, proč je v současné době barvení Giemsa nejčastěji používáno pro diagnostiku chlamydiových infekcí, zejména pokud je jich málo..
Doporučení pro dobré barvení
Sušení listů by nemělo být urychleno. Čas na obezřetnost musí být vyčkán na jeho sušení pod širým nebem. Přibližně 2 hodiny.
Nejlepších výsledků dosáhnete okamžitě po 2 hodinách.
Aby byly nátěry fixovány a obarveny lépe, musí být vzorek rozložen na fólii tak, aby zůstala tenká a rovnoměrná vrstva.
Preferovaným vzorkem krve je kapilára, protože stěr je vytvořen přímo z kapky krve, a proto vzorek nemá žádnou přísadu, která by podporovala udržování buněčných struktur..
Pokud se však používá žilní krev, měla by se EDTA používat jako antikoagulant a nikoli heparin, protože tyto buňky obvykle deformují buňky..
Časté chyby ve zbarvení Giemsy
V praxi tohoto zbarvení mohou být chyby. Důkazem toho jsou náhlé změny v odstínech struktur.
Extrémně modré zbarvení
Může to být způsobeno:
- Velmi silné šmouhy
- Překročení doby barvení
- Příliš málo mytí.
- Použití činidel dobře nad neutrálním pH (alkalické).
Za těchto podmínek jsou barvy následujících struktur zkreslené, takže erytrocyty namísto umírajícího růžového lososa budou vypadat zeleně, granule eosinofilů, které by měly být zbarveny do červených cihel, se zbarví modře nebo šedě a tak na nich bude. odchylky v obvyklých tonalitách.
Nadměrně růžové zabarvení
Může to být způsobeno:
- Nedostatečný čas barvení.
- Dlouhodobé nebo nadměrné praní.
- Špatné sušení.
- Použití velmi kyselých činidel.
V tomto konkrétním případě struktury, které jsou normálně obarvené modře, nebudou téměř viditelné, zatímco struktury, které jsou obarveny do růžova, budou mít velmi přehnané tonality.
Příklad: erytrocyty budou mít jasně červenou nebo silně oranžovou barvu, jaderný chromatin bude vypadat světle růžově a granule eosinofilů budou jasně červené..
Přítomnost sraženin v nátěru
Příčiny mohou být:
- Používejte špinavé nebo špatně umyté listy.
- Nedovolte, aby stěr zaschl dobře.
- Fixační roztok ponechte příliš dlouho.
- Nedostatečné promývání na konci barvení.
- Nedostatečná filtrace nebo nefiltrování použitého barviva.
Přítomnost morfologických artefaktů
Morfologické artefakty se mohou objevit v šmouhách, což ztěžuje vizualizaci a interpretaci přítomných struktur. Důvodem je:
- Typ použitého antikoagulačního činidla, jako je heparin.
- Použití špinavých, poškozených nebo mastných listů.
Režim ukládání
Po přípravě by barvivo mělo být uchováváno při pokojové teplotě (15 - 25 ° C), aby se zabránilo vysrážení barviva. Musí být skladován v uzavřené jantarové nádobě.
Odkazy
- Cannova D, Brito E a Simons M. Vyhodnocení technik barvení pro diagnostiku kožní leishmaniózy. Salus. 2016; 20 (2): 24-29.
- Reagencie PanReac Applichem ITW. Barvy Giemsa. Verze 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Španělsko.
- Clark G. Postupy barvení (1981), 4th. Williams & Willkins.
- Aplikovaná klinická chemie Barvivo Giemsa pro diagnostiku in vitro. Distributor: cromakit.es
- Ramírez I, Mejía M, García de la Riva J, Hermes F a Grazioso C. Platnost barviv Giemsa a Lendrum ve spojivkových nátěrech pro identifikaci Chlamydia trachomatis. Bol Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. Obecná mykologie. 1994. 2. ed. Universidad Central de Venezuela, edice knihovny. Venezuela, Caracas.
- "Giemsa skvrna." Experimentální strojový překlad hesla Wikipedia z encyklopedie Wikipedia pořízený překladačem Eurotran. 1. září 2017, 01:02 UTC. 6. prosince 2018, en.wikipedia.org.


