Acinetobacter baumannii charakteristiky, morfologie, metabolismus
Acinetobacter baumannii Je to gram-negativní bakterie, patřící do řádu pseudomonas. Během své taxonomické historie se nachází v rodech Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea a Achromobacter, dokud ne to bylo lokalizováno v jeho aktuálním žánru v 1968.
A. baumannii Je to patogenní bakterie, která je považována za druh nejčastěji se účastní infekcí v rámci svého rodu. Podílela se na různých typech infekcí, jako je septikémie, pneumonie a meningitida..
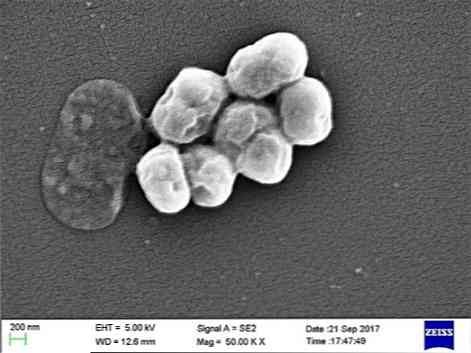
Jedná se o oportunistický parazit, který má významný výskyt v nemocničních nebo nozokomiálních onemocněních. Přenos mechanickou ventilací je indikován jako důležitá příčina infekce, zejména v jednotkách intenzivní péče.
Navzdory tomu, že je považován za patogen nízkého stupně, má schopnost zvýšit svou virulenci u kmenů účastnících se častých infekcí. Má velkou schopnost vyvíjet rezistenci a multirezistenci vůči antibiotikům.
V nemocnicích se přenášejí hlavně kontaktem personálu, použitím kontaminovaných nemocničních materiálů a také vzduchem na krátké vzdálenosti..
Světová zdravotnická organizace zahrnuje A. baumannii v seznamu rezistentních patogenů, pro které jsou naléhavě vyžadována nová antibiotika, s přiřazením kategorie 1 s kritickou prioritou.
Index
- 1 Biologické charakteristiky
- 2 Morfologie
- 3 Metabolismus
- 4 Rezistence vůči antibiotikům
- 5 Patologie
- 6 Příznaky
- 7 Léčba
- 8 Odkazy
Biologické charakteristiky
Všechny druhy rodu Acinetobacter mají širokou distribuci v různých přírodních výklencích. A. baumannii může přirozeně obývat kůži zdravých lidí, je schopen kolonizovat sliznice, což představuje důležitou epidemiologickou rezervoár. Nicméně, lokalita A. baumannii je to téměř výlučně v nemocničním prostředí.
Tyto bakterie postrádají bičík nebo struktury používané pro pohyb. Dosahují však pohybu strukturami, které jim umožňují expandovat a zatahovat, a chemické mechanismy, jako je vylučování filmu s vysokou molekulovou hmotností exopolysacharidu za bakterií..
A. baumannii může kolonizovat velké množství živých nebo inertních prostředí a má velkou schopnost přežít na umělých površích po delší dobu.
Tato schopnost je možná způsobena schopností odolávat dehydrataci, používat různé zdroje uhlíku různými metabolickými cestami a možností tvorby biofilmů. Z tohoto důvodu je běžné, že se nachází v nemocničním vybavení, jako jsou katétry a mechanická ventilační zařízení.
Morfologie
A. baumannii je coccobacillus, přechodný ve tvaru mezi kokosy a hole. Měří od 1,5 do 2,5 od 1 do 1,5 mikronu, když jsou populace v logaritmické fázi růstu. Oni jsou více sférické, když dosáhnou stacionární fáze.
Metabolismus
Bakterie A. baumannii není to fermentor glukózy; je přísný aerobní, to znamená, že pro svůj metabolismus vyžaduje kyslík.
Druhy rodu Acinetobacter oni jsou jediní rodiny Moraxellaceae, která postrádá cytochrom c oxidases, pro kterého oni dávají negativní výsledky v testech oxidases \ t.
A. baumannii roste při teplotách, které se pohybují mezi 20 a 44 ° C, jeho optimální teplota je mezi 30 a 35 ° C.
Rezistence vůči antibiotikům
Neustálá tvorba rezistence vůči antibiotikům nejenže brání léčbě a kontrole infekcí vyvolaných A. baumannii, Podporuje také výběr endemických a epidemických multirezistentních kmenů.
Některé vnitřní mechanismy A. baumannii, podporující rezistenci vůči antibiotikům:
- Přítomnost β-laktamázy poskytují rezistenci vůči b-laktamům.
- Produkce specifických enzymů, jako je amoniglukosid-3'-fosfotransferáza VI, inaktivuje amikacin.
- Přítomnost oxacilinázy OXA-51 hydrolyzuje peniciliny a karbapenemy.
- Přítomnost a nadměrná exprese refluxních čerpadel, což jsou čerpadla, která vysílají malé molekuly mimo buňku, která proniká cytoplazmou, čímž se snižuje jejich citlivost na antibiotika.
Biofilmy vytvořené A. baumannii mění metabolismus mikroorganismů, snižují jejich citlivost na antibiotika a poskytují fyzickou bariéru proti velkým molekulám a zabraňují dehydrataci bakterií.
Patologie
A. baumannii kolonizuje nového hostitele kontaktem s infikovanými lidmi nebo s kontaminovaným zdravotnickým vybavením. Za prvé, tyto bakterie ulpívají na povrchu kůže a sliznic. Pro reprodukci musí přežít antibiotická a inhibiční činidla a podmínky těchto povrchů.
Zvýšení počtu bakterií na slizničních površích, zejména v podmínkách hospitalizace v kontaktu s intravaskulárními katétry nebo endotracheálními zkumavkami, může napomoci riziku infekce dýchacích cest a krevního oběhu..
Pneumonie nakažená v nemocnicích je nejběžnější infekcí produkovaných A. baumanii. Běžně sjednáni v jednotkách intenzivní péče pacienty, kteří dostávali mechanicky asistované dýchání.
A. baumanii To také způsobilo velké problémy v důsledku infekcí vojenského personálu s poválečnými traumaty, konkrétně v Iráku a Afghánistánu. Konkrétně v důsledku osteomyelitidy a infekcí měkkých tkání, které mohou způsobit nekrózu a celulitidu.
Existují také rizika meningitidy A. baumanii u pacientů zotavujících se z neurochirurgických výkonů.
Jedinci náchylní k infekci A. baumanii zahrnují ty, které byly dříve podrobeny užívání antibiotik, velkých operací, popálenin, traumatu, imunosuprese nebo použití invazivních zdravotnických prostředků, zejména mechanické ventilace, v jednotkách intenzivní péče.
Příznaky
Neexistuje žádná specifická symptomatologie infekcí způsobených A. baumanii. Každá z různých infekcí produkovaných touto bakterií má své vlastní charakteristické příznaky.
Obecně platí, že příznaky infekcí, které mohou zahrnovat A. baumanii nebo jiné oportunistické bakterie Klebsiella pneumoniae a Streptococcus pneumoniae, může zahrnovat horečku, zimnici, vyrážku, bolestivé močení, naléhavou potřebu častého močení, zmatenost nebo změněné duševní stavy, nevolnost, bolesti svalů, bolesti na hrudi a kašel.
Léčba
Antibiotika k léčbě infekcí A. baumannii jsou velmi omezené, vzhledem k jejich velké schopnosti získat odpor a multirezistenci. Proto je důležité určit citlivost každého kmene na různá antibiotika, aby byla zajištěna účinnost každé léčby.
Vzhledem k rezistenci vůči karbapenemům bylo použito polymyxinů, konkrétně kolistinu, navzdory relativně nízkému indexu rezistence a jeho vedlejším účinkům na ledviny..
Kmeny rezistentní na kolistin však již byly detekovány. Jako alternativa k rezistenci na tato antibiotika byla použita kombinovaná terapie.
Odkazy
- Bergogne-Bérézin, E. & Towner, K.J.. Acinetobacter spp. jako nozokomiální patogeny: mikrobiologické, klinické a epidemiologické znaky. Clin. Microbiol. Rev. 9 (1996), pp. 148-165.
- Fournier, P.E., Richet, H. (2006). Epidemiologie a kontrola Acinetobacter baumanii zdravotnických zařízeních. Clinical Infectious Diseases, 42: 692-9.
- Hernández Torres, A., García Vázquez, E., Yagüe, G. &, Gómez Gómez, J. (2010) Acinetobacter baumanii multiresistant: současná klinická situace a nové perspektivy Spanish Journal of Chemotherapy, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: Epidemiologie, antimikrobiální rezistence a možnosti léčby. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.j., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: lidské infekce, faktory přispívající k patogenezi a zvířecí modely. FEMS Microbiology Reviews, 37: 130-155.
- Peleg, A.Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: vznik úspěšného patogenu. Clinical Microbiology Reviews, 21 (3): 538-82.
- Vanegas-Múnera, J. M., Roncancio-Villamil, G. & Jiménez-Quiceno, J.N. (2014). Acinetobacter baumannii: klinický význam, mechanismy rezistence a diagnóza. CES Medicine Journal, 28 (2): 233-246.


