Sulfid hlinitý (Al2S3) Chemická struktura, nomenklatura, vlastnosti
sulfid hlinitý (Al2S3) je světle šedá chemická sloučenina tvořená oxidací kovového hliníku ztrácí elektrony poslední úrovně energie a stává se kationtem a redukcí nekovové síry tím, že získává elektrony získané hliníkem a stává se anion.
Aby k tomu mohlo dojít a hliník může přinést své elektrony, je nutné předložit tři hybridní orbital sp3, které poskytují možnost tvorby vazeb s elektrony ze síry.

Citlivost sulfidu hlinitého na vodu znamená, že v přítomnosti vodní páry ve vzduchu může reagovat na výrobu hydroxidu hlinitého (Al (OH)).3), sirovodíku (H2S) a vodík (H2plynné; pokud se tento akumulátor akumuluje, může způsobit výbuch. Obaly sulfidu hlinitého by proto měly být vyrobeny pomocí vzduchotěsných nádob.
Na druhé straně, protože sulfid hlinitý má reaktivitu s vodou, je to prvek, který nemá rozpustnost v uvedeném rozpouštědle.
Index
- 1 Chemická struktura
- 1.1 Molekulární vzorec
- 1.2 Strukturní vzorec
- 2 Vlastnosti
- 2.1 Fyzikální vlastnosti
- 2.2 Chemické vlastnosti
- 3 Použití a aplikace
- 3.1 V superkondenzátorech
- 3.2 U sekundárních lithiových baterií
- 4 Rizika
- 4.1 Postup první pomoci
- 4.2 Opatření pro hasební zásah
- 5 Odkazy
Chemická struktura
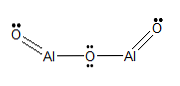
Molekulární vzorec
Al2S3
Strukturní vzorec
- Sulfid hlinitý.
- Diisulfid hlinitý.
- Sulfid hlinitý (III).
- Sulfid hlinitý.
Vlastnosti
Chemické sloučeniny většinou vykazují dva druhy vlastností: fyzikální a chemické.
Fyzikální vlastnosti
Molární hmotnost
150,158 g / mol
Hustota
2,02 g / ml
Teplota tání
1100 ° C
Rozpustnost ve vodě
Nerozpustný
Chemické vlastnosti
Jednou z hlavních reakcí sulfidu hlinitého je voda, jako substrát nebo hlavní činidlo:

Při této reakci lze pozorovat tvorbu hydroxidu hlinitého a sirovodíku, pokud je ve formě plynu, nebo sirovodíku, pokud je rozpuštěn ve vodě jako roztok. Jeho přítomnost je identifikována vůní shnilých vajec.
Použití a aplikace
V superkondenzátorech
Sulfid hliníku se používá při výrobě nano síťových struktur, které zlepšují specifickou povrchovou plochu a elektrickou vodivost takovým způsobem, že lze dosáhnout vysoké kapacitní kapacity a hustoty energie, jejichž použitelnost je stejná jako u superkapacitorů..
Grafen oxid (GO) - grafen je jednou z allotropických forem uhlíku - sloužil jako podpora sulfidu hlinitého (Al2S3) s hierarchickou morfologií podobnou nano-montaně vyráběné hydrotermální metodou.
Účinek grafen oxidu
Charakteristiky grafen oxidu jako podpora, stejně jako vysoká elektrická vodivost a povrch, aby nanorambutant Al2S3 být elektrochemicky aktivní.
CV specifické křivky kapacitance s dobře definovanými redox píky potvrzují pseudo-kapacitní chování nanorambutanů Al2S3 hierarchické, udržované v oxidu grafenu v 1M NaOH elektrolytu. Specifické hodnoty CV kapacitance získané z křivek jsou: 168,97 při rychlosti skenování 5 mV / s.
Kromě toho byla pozorována dobrá doba galvanostatického výboje 903 μs, velká specifická kapacita 2178,16 při proudové hustotě 3 mA / Cm2. Hustota energie vypočtená z galvanostatického výboje je 108,91 Wh / Kg při proudové hustotě 3 mA / Cm2.
Elektrochemická impedance tak potvrzuje pseudo-kapacitní povahu hierarchické nano-kolébkové elektrody Al2S3. Test stability elektrody vykazuje 57,44% retenci specifické kapacity až 1000 cyklů.
Experimentální výsledky naznačují, že nanorambutant Al2S3 Hierarchické je vhodné pro superkondenzátorové aplikace.
V sekundárních lithiových bateriích
Se záměrem vyvinout sekundární lithiovou baterii s vysokou hustotou energie, sulfid hlinitý (Al2S3) jako aktivní materiál.
Počáteční vypouštěcí kapacita měřená od Al2S3 byla přibližně 1170 mAh g-1 při 100 mA g-1. To odpovídá 62% teoretické kapacity síry.
Al2S3 vykazovaly špatnou retenci kapacity v rozsahu potenciálu mezi 0,01 V a 2,0 V, zejména v důsledku strukturní nevratnosti procesu nabíjení nebo extrakce Li..
Analýzy XRD a K-XANES pro hliník a síru ukázaly, že povrch Al2S3 reaguje reverzibilně během procesu nakládání a vykládání, zatímco jádro Al2S3 ukázaly strukturální nevratnost, protože LiAl a Li2S byly vytvořeny z Al2S3 v počátečním stažení a pak zůstali tak, jak byly.
Rizika
- Při styku s vodou uvolňuje hořlavé plyny, které se mohou samovolně spálit.
- Způsobuje podráždění kůže.
- Způsobuje vážné podráždění očí.
- Může způsobit podráždění dýchacích cest.
Informace se mohou lišit v závislosti na nečistotách, přísadách a dalších faktorech.
Postup první pomoci
Obecná léčba
Pokud příznaky přetrvávají, vyhledejte lékařskou pomoc.
Speciální ošetření
Žádný
Důležité příznaky
Žádný
Inhalace
Vezměte oběť venku. Dodávejte kyslík, pokud je dýchání obtížné.
Požití
Podejte jedno nebo dvě sklenice vody a vyvolejte zvracení. Osobě v bezvědomí nikdy nevyvolávejte zvracení ani dávejte nic ústy.
Kůže
Zasažené místo omyjte vodou a jemným mýdlem. Odstraňte kontaminovaný oděv.
Oči
Umyjte si oči vodou, několik minut často bliká. Vyjměte kontaktní čočky, pokud jsou přítomny, a pokračujte v oplachování.
Protipožární opatření
Hořlavost
Není hořlavý.
Hasicí prostředky
Reaguje s vodou. Nepoužívejte vodu: použijte CO2, písek a hasicí prášek.
Postup boje
Použijte izolační dýchací přístroj s plnou ochranou. Používejte oděv, abyste se vyhnuli kontaktu s pokožkou a očima.
Odkazy
- Salud y Riesgos.com, (s.f), Definice, pojmy a články o zdraví, rizicích a životním prostředí. Obnoveno: saludyriesgos.com
- Sulfid hlinitý. (s.f) Na Wikiwandu. Získáno dne 9. března 2018: wikiwand.com
- Webové prvky (S.f) .Dialuminium Trisulpfide, obnoveno 10. března 2018: webelements.com
- Iqbal, M., Hassan, M., M., Bibi.S., Parveen, B. (2017). Vysoká specifická kapacita a hustota energie syntetizované hierarchické báze na bázi oxidu hlinitého Al2S3 Nanorambutan pro aplikaci superkapacitoru, Electrochimica Acta, Svazek 246 ,Stránky 1097-1103
- Senoh, H., Takeuchi, T., Hiroyuki K., Sakaebe, H., M., Nakanishi, K., Ohta, T., Sakai, T., Yasuda, K. (2010). Elektrochemické vlastnosti sulfidu hlinitého pro použití v lithiu.Časopis zdrojů energie,Svazek 195, Problém 24, Stránky 8327-8330 doi.org
- LTS Research Laboratories, Inc (2016), Bezpečnostní list Sulfid hliníku: ltschem.com