Fyzikální a chemické vlastnosti organických solí, použití a příklady
organické soli jedná se o hustý počet iontových sloučenin s nesčetnými vlastnostmi. Odvozují se dříve z organické sloučeniny, která prošla transformací, která jí umožňuje být nosičem náboje, a také její chemická identita závisí na asociovaném iontu..
Na obrázku níže jsou uvedeny dva velmi obecné chemické vzorce pro organické soli. První z nich, R-AX, je interpretován jako sloučenina, jejíž uhlíková struktura atom nebo skupina A nese kladný náboj + nebo negativní (-).
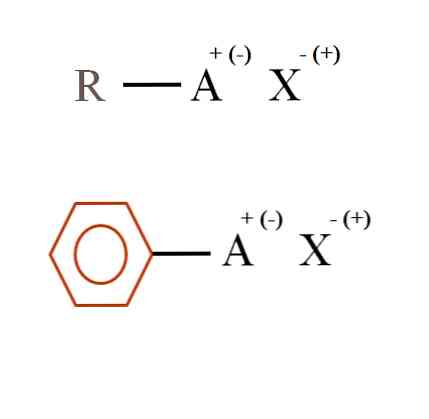
Jak je vidět, existuje kovalentní vazba mezi R a A, R-A, ale zase má A formální náboj, který přitahuje (nebo odpuzuje) ionty X. Znak náboje bude záviset na povaze A a chemickém prostředí.
Pokud by A bylo kladné, kolik X by s ním mohl spolupracovat? Pouze s jedním, vzhledem k principu electroneutrality (+ 1-1 = 0). Jaká je však identita X? Anion X by mohl být CO32-, vyžadující dvě kationty RA+; halogenid: F-, Cl-, Br-, atd.; nebo dokonce další RA sloučenina-. Možnosti jsou nevyčíslitelné.
Také organická sůl může mít aromatický charakter, znázorněný v hnědém benzenovém kruhu. Sůl benzoátu měďnatého (II), (C6H5COO)2Cu se například skládá ze dvou aromatických kruhů se záporně nabitými karboxylovými skupinami, které interagují s kationtem Cu.2+.
Index
- 1 Fyzikální a chemické vlastnosti
- 1.1 Vysoké molekulové hmotnosti
- 1.2 Amfifily a povrchově aktivní látky
- 1.3 Bod varu nebo bod tání
- 1.4 Kyslost a zásaditost
- 2 Použití
- 3 Příklady organických solí
- 3.1 Karboxyláty
- 3.2 Diarylupráty lithné
- 3.3 Soli sulfonia
- 3.4 Soli oxonia
- 3.5 Aminové soli
- 3.6 Diazoniové soli
- 4 Odkazy
Fyzikální a chemické vlastnosti
Z obrázku lze konstatovat, že organické soli se skládají ze tří složek: organické, R nebo Ar (aromatický kruh), atom nebo skupina nesoucí iontový náboj A a protiion X.
Stejně jako chemická identita a struktura jsou těmito složkami definovány, jejich vlastnosti na nich závisí.
Z této skutečnosti lze shrnout některé obecné vlastnosti, které vyhovují převážné většině těchto solí.
Vysoké molekulové hmotnosti
Za předpokladu mono- nebo polyvalentních anorganických aniontů X mají organické soli obvykle mnohem větší molekulové hmotnosti než anorganické soli. Toto je hlavně kvůli uhlíkové kostře, jehož jednoduché C-C vazby, a jejich atomy vodíku, přispívají hodně hmoty ke sloučenině..
Proto jsou R nebo Ar zodpovědné za jejich vysoké molekulové hmotnosti.
Amfifily a povrchově aktivní látky
Organické soli jsou amfifilní sloučeniny, to znamená, že jejich struktury mají jak hydrofilní, tak hydrofobní konce.
Jaké jsou takové extrémy? R nebo Ar představují hydrofobní konec, protože jejich atomy C a H nemají velkou afinitu k molekulám vody.
A+(-), atom nebo skupina nesoucí náboj, je hydrofilní konec, protože přispívá k dipolárnímu momentu a interaguje s dipóly tvořícími vodu (RA)+ OH2).
Když jsou hydrofilní a hydrofobní oblasti polarizovány, amfifilní sůl se stává povrchově aktivním činidlem, látkou široce používanou pro výrobu detergentů a látek. demulgátory.
Vysoké teploty varu nebo tání
Podobně jako anorganické soli mají organické soli také vysoké teploty tání a teploty varu v důsledku elektrostatických sil, které se řídí kapalnou nebo pevnou fází..
Nicméně, mít organickou složku R nebo Ar, jiné druhy Van der Waals síly (Londýn síly, dipól-dipól, vodíkové mosty) to soutěžit v jistém způsobu s elektrostatickým \ t.
Z tohoto důvodu jsou pevné nebo kapalné struktury organických solí v první řadě složitější a rozmanitější. Někteří se mohou chovat stejně kapalné krystaly.
Kyslost a zásaditost
Organické soli jsou obvykle silnější kyseliny nebo báze než anorganické soli. Je tomu tak proto, že A, například v aminových solích, má kladný náboj v důsledku své vazby s dalším vodíkem: A+-H. Poté, v kontaktu s bází, darujte proton, aby se vrátil jako neutrální sloučenina:
RA+H + B => RA + HB
H patří do A, ale je napsán, jakmile zasahuje do neutralizační reakce.
Na druhou stranu, RA+ to může být velká molekula, neschopná tvořit pevné látky s krystalickou sítí dostatečně stabilní s hydroxylovým aniontem nebo hydroxylovým OH-.
V tomto případě se jedná o sůl RA+OH- chová se jako silná základna; dokonce jako bazický jako NaOH nebo KOH:
RA+OH- + HC1 => RACl + H2O
Všimněte si chemické rovnice, že Cl anion- nahrazuje OH-, tvořící sůl RA+Cl-.
Použití
Použití organických solí se bude lišit v závislosti na identitě R, Ar, A a X. Kromě toho aplikace, ke které jsou určeny, závisí také na typu pevné látky nebo kapaliny, kterou tvoří. Některé obecné zásady v tomto ohledu jsou:
-Slouží jako činidla pro syntézu dalších organických sloučenin. RAX může působit jako "donor" řetězce R, který má být přidán do jiné sloučeniny nahrazující dobrou odchozí skupinu.
-Jsou to povrchově aktivní látky, takže mohou být také použity jako maziva. Pro tento účel se používají kovové soli karboxylátů.
-Umožňují syntetizovat širokou škálu barviv.
Příklady organických solí
Karboxyláty
Karboxylové kyseliny reagují s hydroxidem v neutralizační reakci, čímž vznikají soli karboxylátů: RCOO- M+; kde M+ Může to být jakýkoliv kovový kation (Na+, Pb2+, K+, atd.) nebo NH amonný kation4+.
Mastné kyseliny jsou alifatické karboxylové kyseliny s dlouhým řetězcem, mohou být nasycené a nenasycené. Mezi nasycené patří kyselina palmitová (CH)3(CH2)14COOH). Vzniká palmitátová sůl, zatímco kyselina stearová (CH3(CH2)16COOH tvoří stearátovou sůl. Mýdla jsou tvořena těmito solemi.
V případě kyseliny benzoové, C6H5COOH (kde C6H5- jedná se o benzenový kruh), když reaguje se zásadou tvoří benzoátové soli. Ve všech karboxylátech je skupina -COO- představuje A (RAX).
Diaupupráty lithné
Diacuprát lithný je užitečný v organické syntéze. Jeho vzorec je [R-Cu-R]-Li+, ve kterém atom mědi nese záporný náboj. Zde měď představuje atom A obrazu.
Sulfoniové soli
Jsou tvořeny reakcí organického sulfidu s alkylhalogenidem:
R2S + R'X => R2R'S+X
Pro tyto soli nese atom síry pozitivní formální náboj (S)+) mající tři kovalentní vazby.
Oxoniové soli
Také ethery (okysličené analogy sulfidů) reagují s hydrocidy za vzniku oxoniových solí:
ROR '+ HBr <=> RO+HR '+ Br-
Kyselinový proton HBr je kovalentně vázán na atom kyslíku etheru (R.)2O+-H), kladně.
Aminové soli
Aminy mohou být primární, sekundární, terciární nebo kvartérní, jakož i jejich soli. Všechny z nich jsou charakterizovány tím, že mají atom dusíku spojený s atomem dusíku.
Takže, RNH3+X- jedná se o primární aminovou sůl; R2NH2+X-, sekundárního aminu; R3NH+X-, terciárního aminu; a R4N+X-, kvartérního aminu (kvartérní amonná sůl).
Diazoniové soli
Konečně diazoniové soli (RN.)2+X-) nebo arildiazonium (ArN)2+X-), představují výchozí bod mnoha organických sloučenin, zejména azobarviv.
Odkazy
- Francis A. Carey. Organická chemie (Šesté vydání, str. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organická chemie. Aminy (10. vydání). Wiley Plus.
- Wikipedia. (2018). Sůl (Chemie). Převzato z: en.wikipedia.org
- Steven A. Hardinger. (2017). Ilustrovaný glosář organické chemie: soli. Zdroj: chem.ucla.edu
- Chevron Oronite. (2011). Karboxyláty. [PDF] Zdroj: oronite.com


