Hydroxid strontnatý (Sr (OH) ₂) chemická struktura, vlastnosti a použití
hydroxid strontnatý (Sr (OH) ₂) je anorganická chemická sloučenina sestávající z iontů stroncia (Sr) a dvou hydroxidových (OH) iontů. Tato sloučenina se získá kombinací soli stroncia se silnou bází, což vede ke sloučenině alkalické povahy, jejíž chemický vzorec je Sr (OH)2.
Jako silná báze pro přípravu hydroxidu strontnatého se obecně používá hydroxid sodný (NaOH) nebo hydroxid draselný (KOH). Na druhou stranu, sůl stroncia (nebo iontu stroncia), která reaguje se silnou bází, je dusičnan strontnatý Sr (NO3)2 a proces je popsán následující chemickou reakcí:
2KOH + Sr (NO3)2 → 2KNO3 + Sr (OH)2
V roztoku je stronciový kation (Sr+) se uvede do styku s hydroxidovým aniontem (OH)-) vytvoření bazické iontové soli stroncia. Vzhledem k tomu, že stroncium je kov alkalických zemin, hydroxid strontnatý se považuje za žíravou alkalickou sloučeninu.
Index
- 1 Získání
- 2 Chemická struktura a fyzikálně-chemické vlastnosti
- 2.1 Octahydrát hydroxidu stroncia
- 2.2 Monohydrát hydroxidu strontnatého
- 2.3 Bezvodý hydroxid strontnatý
- 2.4 Rozpustnost
- 2.5 Chemická reaktivita
- 3 Použití
- 3.1 Extrakce melasy a rafinace cukrové řepy
- 3.2 Strontnaté tuky
- 3.3 Plastový stabilizátor
- 3.4 Další aplikace
- 4 Odkazy
Získání
Kromě výše popsaného procesu lze říci, že jakmile byla reakce provedena, Sr (OH)2 precipituje v roztoku. Poté se podrobí procesu praní a sušení a nakonec se získá velmi jemný bílý prášek.
Alternativní způsob získávání hydroxidu strontnatého je zahřívání uhličitanu strontnatého (SrCO).3) nebo síranu stroncia (SrSO)4) s párou při teplotě mezi 500 ° C a 600 ° C. K chemické reakci dochází, jak je uvedeno níže:
SrCO3 + H2O → Sr (OH)2 + CO2
SrS + 2H2O → Sr (OH)2 + H2S
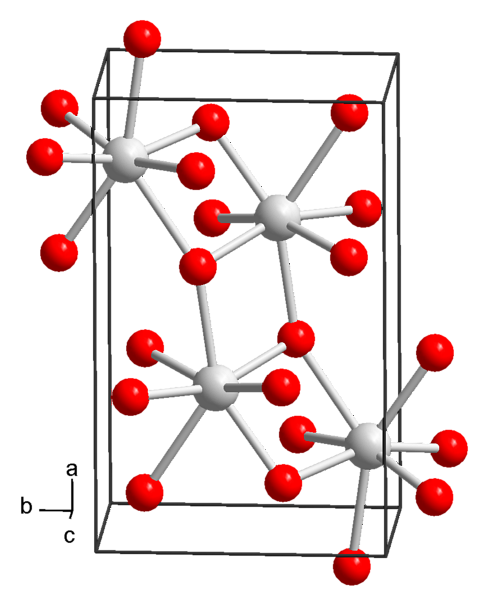
Chemická struktura a fyzikálně-chemické vlastnosti
V současné době jsou známy 3 formy hydroxidu strontnatého: oktahydrát, monohydrát a bezvodý.
Octahydrát hydroxidu stroncia
Z roztoků za normálních podmínek teploty a tlaku (25 ° C a 1 atm) se hydroxid strontnatý vysráží ve formě oktahydrátu, jehož chemický vzorec je Sr (OH)2∙ 8H2O.
Tato sloučenina má molární hmotnost 265,76 g / mol, hustotu 1,90 g / cm a precipituje jako tetragonální krystaly (s prostorovou skupinou P4 / ncc) čtyřúhelníkového a bezbarvého prizmatického vzhledu..
Oktahydrát hydroxidu strontnatého má také schopnost absorbovat atmosférickou vlhkost, protože se jedná o snadno rozptylující sloučeninu..
Monohydrát hydroxidu strontnatého
Podle studií optické mikroskopie (prováděných technikou rentgenové difrakce), zvýšením teploty na přibližně 210 ° C - při konstantním atmosférickém tlaku - Sr (OH)2∙ 8H2Nebo je dehydratován a přeměněn na monohydrát hydroxidu strontnatého (Sr (OH)2∙ H2O).
Tato forma sloučeniny má molární hmotnost 139,65 g / mol a její teplota tání je -73,15 ° C (375 K). Vzhledem ke své atomové konfiguraci má nižší rozpustnost ve vodě než ta, která je popsána v jeho oktahydrátu.
Bezvodý hydroxid strontnatý
Pokračováním ve zvyšování teploty systému na přibližně 480 ° C pokračuje dehydratace, dokud se nezíská bezvodý hydroxid strontnatý..
Na rozdíl od hydratovaných forem má molekulovou hmotnost 121,63 g / mol a hustotu 3,625 g / cm3. Jeho bod varu je dosažen při 710 ° C (1310 ° F nebo 983 K), zatímco bod tání je při 535 ° C (995 ° F nebo 808 K)..
Rozpustnost
Oktahydrát hydroxidu stroncia má rozpustnost ve vodě 0,91 gramu na 100 mililitrů (měřeno při 0 ° C), zatímco jeho bezvodá forma za podobných teplotních podmínek má rozpustnost 0,41 gramu na 100 mililitrů..
Stejně tak je tato látka považována za nerozpustnou v acetonu a zcela rozpustná v kyselinách a v chloridu amonném.
Chemická reaktivita
Hydroxid strontnatý není hořlavý, jeho chemická reaktivita zůstává stabilní při mírných teplotách a tlacích a je schopna absorbovat oxid uhličitý z atmosférického vzduchu a přeměnit ho na uhličitan stroncia..
Kromě toho je látka silně dráždivá, pokud přijde do styku s kůží, dýchacími cestami nebo jinými sliznicemi těla..
Použití
Vzhledem ke svým hygroskopickým vlastnostem a základním vlastnostem se hydroxid strontnatý používá pro různé aplikace v průmyslu:
- Extrakce melasy a rafinace cukru z řepy.
- Plastový stabilizátor.
- Maziva a maziva.
Extrakce melasy a rafinace cukrové řepy
Na počátku 21. století se hydroxid hydroxidu strontnatého používal v Německu pro rafinaci cukru z cukrové řepy procesem, který patentoval Carl Scheibler v roce 1882.
Tento proces spočívá v míchání hydroxidu strontnatého a cukrové buničiny řepy, což vede k nerozpustnému disacharidu. Tento roztok se oddělí dekantací a po provedení rafinačního procesu se získá cukr jako konečný produkt.
I když je tento postup dodnes používán, existují i další metody s mnohem větší poptávkou, protože jsou levnější, které se používají ve většině světových rafinérií. Například Barsilova metoda, která používá křemičitan barnatý nebo Steffenovu metodu za použití Cal jako extrakčního činidla.
Strontnaté tuky
Jsou to mazací tuky, které obsahují hydroxid strontnatý. Jsou schopny pevně přilnout k povrchům s kovovými vlastnostmi, jsou odolné vůči vodě a odolávají náhlým změnám teploty.
Díky své dobré fyzikální a chemické stabilitě se tyto tuky používají jako průmyslová maziva.
Plastový stabilizátor
Převážná většina plastů vystavených klimatickým faktorům, jako je slunce, déšť a atmosférický kyslík, modifikuje jejich vlastnosti a degradaci.
Vzhledem ke své značné odolnosti vůči vodě se k těmto polymerům přidává hydroxid strontnatý - během fáze tavení - působí jako stabilizátor při výrobě plastových výrobků pro prodloužení jejich životnosti..
Další aplikace
- V průmyslu nátěrových hmot se používá jako základní přísada pro urychlení procesu sušení v komerčních a průmyslových nátěrových hmotách.
- Soli stroncia nebo ionty stroncia se získávají z hydroxidu strontnatého a používají se jako surovina pro výrobu pyrotechnických výrobků..
Odkazy
- Wikipedia. (n.d.). Hydroxid strontnatý. Zdroj: en.wikipedia.org
- PubChem. (s.f.). Hydroxid strontnatý. Zdroj: pubchem.ncbi.nlm.nih.gov
- Lambert, I. a Clever, H. L. (2013). Hydroxidy alkalických zemin ve vodě a vodných roztocích. Citováno z knih.google.co.ve
- Krebs, R. E. (2006). Historie a využití chemických prvků naší Země: Referenční příručka. Citováno z knih.google.co.ve
- Honeywell (s.f.). Octahydrát hydroxidu stroncia. Obnoveno z honeywell.com


