Beryllium hydrid (BeH2) chemická struktura, vlastnosti a použití
hydrid berylnatý "Kovalentní sloučenina" je kovalentní sloučenina vytvořená mezi beryliem kovu alkalických zemin a vodíkem. Jeho chemický vzorec je BeH2, a být kovalentní, to nespočívá v iontu Be2+ ani H-. Spolu s LiH je jedním z nejlehčích hydridů kovů schopných syntézy.
Vyrábí se zpracováním dimethylberilu, Be (CH3)2, s lithiumaluminiumhydridem, LiAlH4. Nicméně, BeH2 Nejčistší se získá pyrolýzou di-terc-butylberylliu, Be (C (CH3)3)2 při 210 ° C.

Jako individuální molekula v plynném stavu, to je lineární v geometrii, ale v pevném a kapalném stavu to polymerizes v řadách trojrozměrných sítí. Je to amorfní pevná látka za normálních podmínek a může se stát krystalickou a vykazovat kovové vlastnosti za velkého tlaku.
Představuje možnou metodu skladování vodíku, buď jako zdroje vodíku při rozkladu, nebo jako pevný absorpční plyn. Nicméně, BeH2 Vzhledem k vysoce polarizační povaze berylia je velmi toxický a znečišťující.
Index
- 1 Chemická struktura
- 1.1 Molekula BeH2
- 1.2 Řetězy BeH2
- 1.3 Trojrozměrné sítě BeH2
- 2 Vlastnosti
- 2.1 Kovalentní charakter
- 2.2 Chemický vzorec
- 2.3 Fyzický vzhled
- 2.4 Rozpustnost ve vodě
- 2.5 Rozpustnost
- 2.6 Hustota
- 2.7 Reaktivita
- 3 Použití
- 4 Odkazy
Chemická struktura
Molekula BeH2
Na prvním obrázku je vidět individuální molekulu hydridu berylia v plynném stavu. Všimněte si, že jeho geometrie je lineární, přičemž atomy H jsou od sebe odděleny o úhel 180 °. Abychom vysvětlili tuto geometrii, atom Be musí mít sp hybridizaci.
Beryllium má dva valenční elektrony, které se nacházejí v orbitálu 2s. Podle teorie valenčních vazeb je jeden z elektronů orbitálu 2s energeticky povýšen na orbitál 2p; a v důsledku toho může nyní tvořit dvě kovalentní vazby se dvěma sp hybridními orbitály.
A co zbytek volných orbitálů Be? K dispozici jsou dva další čisté 2p orbitály, nehybridizované. S nimi prázdné, BeH2 je to deficientní sloučenina elektronů v plynné formě; a tím ochlazením a seskupením jejich molekul kondenzují a krystalizují v polymeru.
BeH Řetězy2
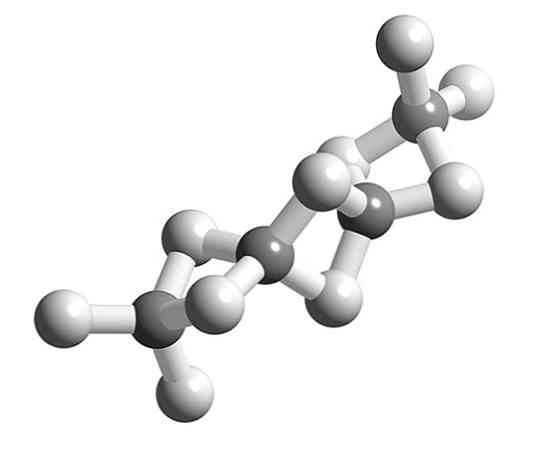
Když jsou molekuly BeH2 polymerizace, okolní geometrie atomu Be přestává být lineární a stává se tetrahedrální.
Dříve byla struktura tohoto polymeru modelována tak, jako by to byly řetězce s jednotkami BeH2 propojené vodíkovými můstky (horní obraz, s kuličkami v bílých a šedých odstínech). Na rozdíl od vodíkových vazeb interakcí dipól-dipól mají kovalentní charakter.
V Be-H-být most polymeru, dva elektrony jsou distribuovány mezi tři atomy (\ todkaz 3c, 2e), které teoreticky musí být umístěny s větší pravděpodobností kolem atomu vodíku (protože je více elektronegativní).
Na druhé straně, Be obklopený čtyřmi H zvládá vyplnit relativně jeho elektronická volná pozice, doplnit jeho valence oktet.
Zde valence teorie vazby bledne dát relativně přesné vysvětlení. Proč? Protože vodík může mít pouze dva elektrony a spojka -H- by zahrnovala účast čtyř elektronů.
Tak, vysvětlit Be-H mosty2-Be (dvě šedé koule spojené dvěma bílými kuličkami) potřebují další komplexní modely vazby, jako jsou ty, které poskytuje molekulární orbitální teorie.
Experimentálně bylo zjištěno, že polymerní struktura BeH2 Nejde o řetězec, ale o třídimenzionální síť.
Trojrozměrné sítě BeH2
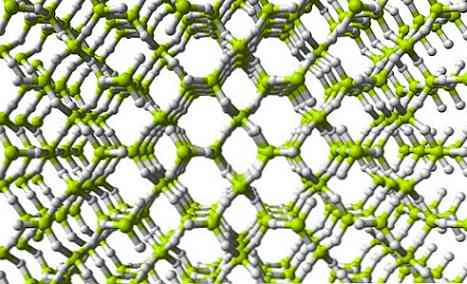
Horní obrázek zobrazuje část trojrozměrné sítě BeH2. Všimněte si, že nažloutlé zelené koule, atomy Be, tvoří čtyřstěn jako v řetězci; nicméně, v této struktuře je větší množství vodíkových mostů, a navíc, strukturální jednotka je už ne BeH2 ale BeH4.
Stejné konstrukční jednotky BeH2 a BeH4 ukazují, že v síti je větší množství atomů vodíku (4 atomy H pro každou Be).
To znamená, že beryllium uvnitř této sítě zvládá naplnit své elektronické volné místo ještě více než v řetězcové polymerní struktuře..
A jako nejzřetelnější rozdíl tohoto polymeru s ohledem na jednotlivé molekuly BeH2, je, že Be musí nutně mít sp hybridizaci3 (Obvykle) vysvětlit tetrahedrální a nelineární geometrie.
Vlastnosti
Kovalentní charakter
Proč je hydrid berylnatý kovalentní a neionogenní sloučeninou? Hydridy ostatních prvků skupiny 2 (Mr. Becamgbara) jsou iontové, to znamená, že se skládají z pevných látek tvořených kationtem M.2+ a dva hydridové anionty H- (MgH2, CaH2, BaH2). Proto, BeH2 Nejedná se o Be2+ ani H- elektrostaticky.
Kation Být2+ je charakterizována vysokou polarizační silou, která deformuje elektronické mraky okolních atomů.
Výsledkem tohoto zkreslení jsou anionty H- jsou nuceni tvořit kovalentní vazby; odkazy, které jsou základním kamenem právě vysvětlených struktur.
Chemický vzorec
BeH2 nebo (BeH2) n
Fyzický vzhled
Bezbarvá amorfní pevná látka.
Rozpustnost ve vodě
Rozpadá se.
Rozpustnost
Nerozpustný v diethyletheru a toluenu.
Hustota
0,65 g / cm3 (1,85 g / l). První hodnota se může týkat plynné fáze a druhá polymerní pevné látky.
Reaktivita
Reaguje pomalu s vodou, ale rychle se hydrolyzuje HC1 za vzniku chloridu berylnatého, BeCl2.
Beryllium hydrid reaguje s Lewisovými bázemi, konkrétně trimethylaminem, N (CH)3)3, za vzniku dimerního aduktu s můstkovými hydridy.
Také může reagovat s dimethylaminem za vzniku trimerního diarylu berylia, [Be (N (CH3)2)2]3 a vodík. Reakce s hydridem lithným, kde iont H- je báze Lewis, tvoří se postupně LIBeH3 a Li2BeH4.
Použití
Hydrid berylnatý může představovat slibný způsob skladování molekulárního vodíku. Rozložením polymeru by se uvolnil H2, který by sloužil jako raketové palivo. Z tohoto přístupu by trojrozměrná síť uložila více vodíku než řetězce.
Také, jak je vidět na obrázku sítě, existují póry, které by umožňovaly hostit molekuly H.2.
Ve skutečnosti, některé studie simulují to, co fyzického úložiště by bylo jako v BeH2 krystalické to znamená, že polymer je vystaven enormním tlakům a jaké jsou jeho fyzikální vlastnosti s různým množstvím adsorbovaného vodíku.
Odkazy
- Wikipedia. (2017). Hydrid berylnatý. Zdroj: en.wikipedia.org
- Armstrong, D.R., Jamieson, J. & Perkins, P.G. Theoret. Chim. Acta (1979) Elektronické struktury polymerního hydridu berylia a polymerního hydridu boru. 51: 163. doi.org/10.1007/BF00554099
- Kapitola 3: Hydrid berylia a jeho oligomery. Zdroj: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger a U. P. Verma. (2014). Studium strukturálního a elektronického chování BeH2 jako sloučenina skladování vodíku: přístup Ab Initio. Conference Papers in Science, sv. ID článku 807893, 5 stran. doi.org/10.1155/2014/807893
- Shiver a Atkins. (2008). Anorganická chemie V Prvcích skupiny 1. (Čtvrté vydání). Mc Graw Hill.


