Typy a příklady molekulární geometrie
molekulární geometrie o molekulární struktury je prostorové rozložení atomů kolem centrálního atomu. Atomy představují oblasti, kde je vysoká elektronická hustota, a proto jsou považovány za elektronické skupiny, bez ohledu na vazby, které se tvoří (jednoduché, dvojité nebo trojité)..
Tento koncept se rodí z kombinačních a experimentálních dat dvou teorií: valenční vazby (TEV) a odpuzování elektronických párů valenční skořepiny (VSPR). Zatímco první definuje vazby a jejich úhly, druhá určuje geometrii, a tedy molekulární strukturu.

Jaké geometrické tvary jsou molekuly schopné přijmout? Obě předchozí teorie poskytují odpovědi. Podle VSEPR musí být atomy a páry volných elektronů uspořádány v prostoru tak, aby se minimalizovalo elektrostatické odpuzování mezi nimi..
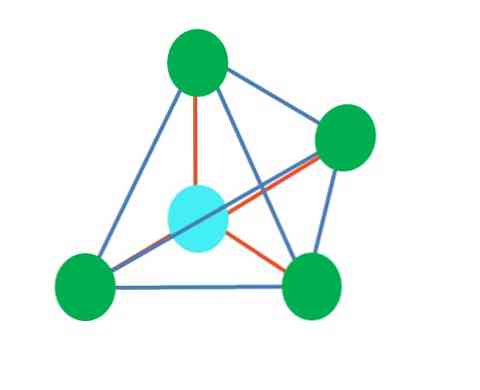
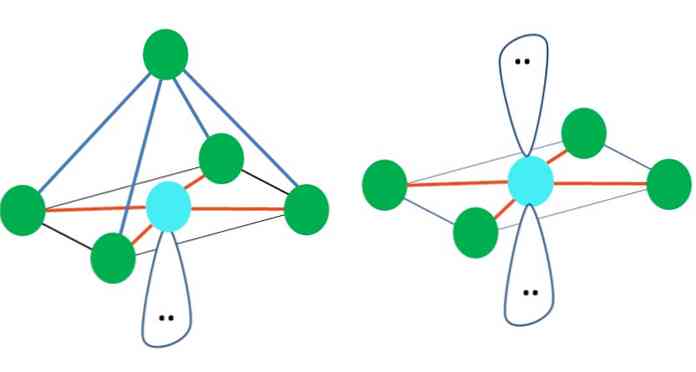
Takže geometrické tvary nejsou libovolné, ale hledají nejstabilnější design. Například, v horním obrazu trojúhelník může být viděn doleva, a octahedron doprava. Zelené tečky představují atomy a oranžové pruhy spojují.
V trojúhelníku jsou tři zelené body orientovány ve vzdálenosti 120 °. Tento úhel, který je stejný jako úhel vazby, umožňuje, aby se atomy navzájem co nejméně odrazily. Proto molekula s centrálním atomem připojeným ke třem dalším přijme geometrii trigonální roviny.
VSCR však předpovídá, že volný pár elektronů v centrálním atomu deformuje geometrii. Pro případ trigonální roviny, tento pár bude tlačit dolů tři zelené body, končit trigonální pyramidovou geometrií.
Totéž se může stát s oktaedronem obrazu. V něm jsou všechny atomy odděleny nejstabilnějším možným způsobem.
Index
- 1 Jak předem poznat molekulární geometrii atomu X?
- 2 Typy
- 2.1 Lineární
- 2.2 Úhlový
- 2.3 Tetrahedral
- 2.4 Trigonální bipyramid
- 2.5 Octahedral
- 2.6 Další molekulární geometrie
- 3 Příklady
- 3.1 Lineární geometrie
- 3.2 Úhlová geometrie
- 3.3 Trigonální plán
- 3.4 Tetrahedral
- 3.5 Trigonální pyramida
- 3.6 trigonální Bipyramid
- 3.7 Kmitání
- 3.8 Tvar T
- 3.9 Octahedral
- 4 Odkazy
Jak předem poznat molekulární geometrii atomu X?
Za tímto účelem je také nutné zvážit dvojice volných elektronů jako elektronických skupin. Tyto, spolu s atomy, budou definovat, co je známo jako elektronická geometrie, což je neoddělitelný společník molekulární geometrie.
Z elektronické geometrie, a když jsme zjistili Lewisovou strukturou dvojice volných elektronů, můžeme zjistit, jaká bude molekulární geometrie. Součet všech molekulárních geometrií poskytne nástin globální struktury.
Typy
Jak je vidět na hlavním obrázku, molekulární geometrie závisí na tom, kolik atomů obklopuje centrální atom. Nicméně, jestliže pár elektronů je přítomný bez sdílení, to změní geometrii protože to zabírá hodně hlasitosti. Proto má sterický účinek.
Podle toho může geometrie představovat řadu charakteristických tvarů pro mnoho molekul. A zde vznikají různé typy molekulární geometrie nebo molekulární struktury.
Kdy se geometrie rovná struktuře? Oba označují totéž pouze v případech, kdy struktura nemá více než jeden typ geometrie; jinak musí být vzaty v úvahu všechny současné typy a struktura musí mít globální název (lineární, rozvětvený, kulový, plochý, atd.).
Geometrie jsou zvláště užitečné pro vysvětlení struktury pevné látky z jejích konstrukčních jednotek.
Lineární
Všechny kovalentní vazby jsou směrové, takže vazba A-B je lineární. Bude však molekula AB lineární?2? Pokud ano, geometrie je jednoduše reprezentována jako: B-A-B. Dva atomy B jsou odděleny úhlem 180 ° a podle TEV musí mít A sp sp orbitály.
Úhlové
V první instanci lze předpokládat lineární geometrii molekuly AB2; je však nezbytné před uzavřením uzavřít strukturu Lewise. Kresba struktury Lewis, jeden může poznat množství párů elektronů bez sdílení (:) na atomu A.
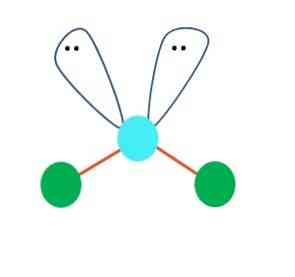
Když je tomu tak, nahoře na elektronových párech tlačí dva atomy B dolů a mění jejich úhly. Jako výsledek, lineární molekula B-A-B skončí stát se V, bumerang nebo úhlová geometrie (horní obraz) \ t
Molekula vody, H-O-H, je ideálním příkladem pro tento typ geometrie. V atomu kyslíku jsou dva páry elektronů bez sdílení, které jsou orientovány v přibližném úhlu 109 °.
Proč tento úhel? Protože elektronická geometrie je tetrahedral, který má čtyři vrcholy: dva pro atomy H, a dva pro elektrony. Na obrázku nahoře si všimněte, že zelené tečky a dva "laloky s očima" kreslí čtyřstěn s modravým bodem v jeho středu.
Jestliže O měl žádné volné elektronové páry, voda by tvořila lineární molekulu, jeho polarita by se snížila a oceány, moře, jezera, etc., odkázaný pravděpodobně neexistují jak oni jsou známí \ t.
Tetrahedral
Horní obrázek představuje tetrahedrální geometrii. Pro molekulu vody, jeho elektronická geometrie je tetrahedral, ale tím, že odstraní elektron-volné páry to může být si všiml, že to je transformováno do úhlové geometrie. Toto je také pozorováno jednoduše tím, že odstraní dvě zelené tečky; zbývající dva budou čerpat V s modrou tečkou.
Co kdyby byl namísto dvou párů volných elektronů jen jeden? Pak by existovala trigonální rovina (hlavní obraz). Vyloučením elektronické skupiny se však nevyhne sterickému účinku vytvořenému dvojicí volných elektronů. Proto deformuje trigonální rovinu na trojúhelníkovou základní pyramidu:

Ačkoli trigonální a tetrahedral pyramida molekulární geometrie jsou různí, elektronická geometrie je stejná: tetrahedral. Trigonální pyramida se tedy nepočítá jako elektronická geometrie?
Odpověď zní ne, protože je výsledkem zkreslení způsobeného „lalokem s očima“ a jeho sterickým efektem a tato geometrie nebere v úvahu pozdější deformace.
Z tohoto důvodu je vždy důležité nejprve určit elektronickou geometrii pomocí Lewisových struktur před definováním molekulární geometrie. Molekula amoniaku, NH3, je příklad molekulární geometrie trigonální pyramidy, ale s tetrahedrální elektronickou geometrií.
Trigonální bipyramid
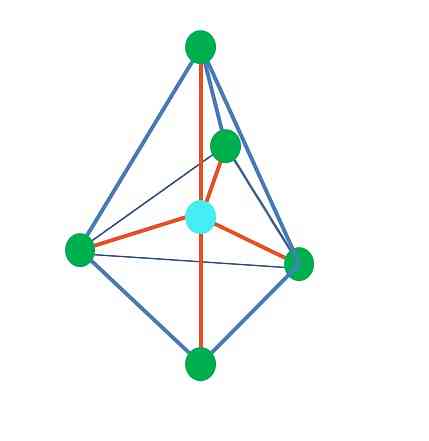
Doposud, s výjimkou lineární geometrie, v tetrahedral, úhlová a trigonální pyramida jeho centrální atomy mají sp hybridizaci3, podle TEV. To znamená, že pokud byly vaše spojovací úhly určeny experimentálně, měly by být kolem 109º.
Od trigonální dipiramidal geometrie, tam je pět elektronických skupin kolem centrálního atomu. V horním obrázku vidíte pět zelených bodů; tři v trojúhelníkové základně a dva v axiálních polohách, které jsou vrcholem vrcholu a dolní vrchol pyramidy.
Jakou hybridizaci má modrá tečka? K vytvoření jednoduchých vazeb potřebuje pět hybridních orbitálů (oranžová). Toho je dosaženo prostřednictvím pěti sp orbitálů3d (produkt směsi orbitálu s, tři p a d).
Když zvažujeme pět elektronických skupin, geometrie je ta již vystavená, ale s dvojicemi elektronů bez sdílení, toto znovu trpí deformacemi, které generují další geometrie. Také vyvstává následující otázka: mohou tyto páry zaujmout jakoukoli pozici v pyramidě? Jedná se o: axiální nebo rovníkové.
Axiální a ekvatoriální polohy
Zelené body, které tvoří trojúhelníkovou základnu, jsou v rovníkových polohách, zatímco dva na horním a dolním konci v axiálních polohách. Kde bude přednostně umístěn pár elektronů bez sdílení? V této poloze minimalizuje elektrostatické odpuzování a sterický efekt.
V axiální poloze by pár elektronů "stlačil" kolmo (90 °) na trojúhelníkovou základnu, zatímco kdyby byl v rovníkové poloze, dvě zbývající elektronické skupiny základny by byly od sebe vzdáleny 120 ° a oba konce by měly být stlačeny na 90 ° (namísto tři, jako u základny).
Centrální atom se proto bude snažit orientovat své páry bez elektronů v ekvatoriálních polohách, aby se vytvořily stabilnější molekulární geometrie.
Oscilační a tvar T
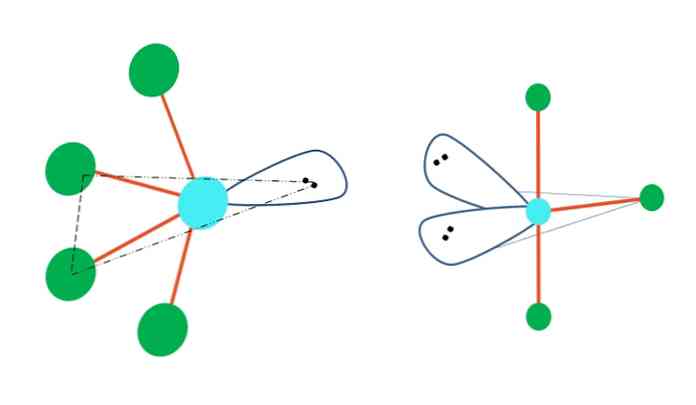
Jestliže trigonální bipyramid geometrie měla nahradit jeden nebo více jeho atomů s elektrony-volné páry, to by také mělo různé molekulární geometrie \ t.
Vlevo od horního obrázku se geometrie změní na oscilační tvar. Volný pár elektronů v něm tlačí zbytek čtyř atomů ve stejném směru, čímž se spojí do leva. Všimněte si, že tento pár a dva atomy leží ve stejné trojúhelníkové rovině původního dipyramidu.
Napravo od obrázku je geometrie ve tvaru písmene T. Tato molekulární geometrie je výsledkem nahrazení dvou atomů dvěma páry elektronů, což má za následek, že zbývající tři atomy jsou zarovnány ve stejné rovině, která kreslí přesně jedno písmeno. T.
Takže pro molekulu typu AB5, přijímá trigonální bipyramidovou geometrii. Nicméně, AB4, se stejnou elektronickou geometrií přijme oscilační geometrii; a AB3, Geometrie ve tvaru písmene T. Ve všech z nich A bude mít (obecně) sp hybridizaci3d.
Pro určení molekulární geometrie je nutné nakreslit Lewisovu strukturu a tedy její elektronickou geometrii. Pokud se jedná o trigonální bipyramid, pak budou páry bez elektronů vyřazeny, ale ne jejich sterické účinky na zbytek atomů. Je tedy možné dokonale rozlišit mezi třemi možnými molekulárními geometriemi.
Octahedral
Vpravo od hlavního obrazu je znázorněna oktaedrická molekulární geometrie. Tento typ geometrie odpovídá sloučeninám AB6. AB4 tvoří čtvercovou základnu, zatímco zbývající dvě B jsou umístěny v axiálních polohách. Tak, několik rovnostranných trojúhelníků být tvořen, který být tváře oktaedron.
Zde opět mohou existovat (stejně jako ve všech elektronických geometriích) volné elektronové páry, a proto z této skutečnosti vyplývají i další molekulární geometrie. Například AB5 s oktaedrickou elektronickou geometrií se skládá z pyramidy se čtvercovou základnou a AB4 čtvercové roviny:
Pro případ oktaedrické elektronické geometrie jsou tyto dvě molekulární geometrie nejstabilnější z hlediska elektrostatického odpuzování. Ve čtvercové-rovinné geometrii, dva páry elektronu jsou 180 ° oddělený.
Jaká je hybridizace atomu A v těchto geometriích (nebo strukturách, pokud je jediná)? TEV opět potvrzuje, že je sp3d2, šest hybridních orbitálů, které umožňují A orientovat elektronické skupiny na vrcholech oktaedronu.
Ostatní molekulární geometrie
Modifikací bází dosud zmíněných pyramid lze získat některé složitější molekulární geometrie. Pětiúhelníkový bipyramid je například založen na pětiúhelníku a sloučeniny, které ho tvoří, mají obecný vzorec AB7.
Podobně jako ostatní molekulární geometrie, i nahrazení atomů B pro páry bez elektronů zkreslí geometrii na jiné formy.
Také sloučeniny AB8 mohou přijmout geometrie, jako je čtvercový antiprismus. Některé geometrie mohou být velmi komplikované, zejména u vzorců AB7 (až do AB12).
Příklady
Dále bude uvedena řada sloučenin pro každou z hlavních molekulárních geometrií. Jako cvičení byste mohli nakreslit Lewisovy struktury pro všechny příklady a potvrdit, zda s ohledem na elektronickou geometrii získáte molekulární geometrie uvedené níže..
Lineární geometrie
-Ethylen, H2C = CH2
-Chlorid berylnatý, BeCl2 (Cl-Be-Cl)
-Oxid uhličitý, CO2 (O = C = O)
-Dusík, N2 (N≡N)
-Dibromid rtuti, HgBr2 (Br-Hg-Br)
-Iion trijodid, I3- (I-I-I)
-Kyanovodík, HCN (H-N ° C)
Jeho úhly musí být 180 °, a proto mají sp hybridizaci.
Úhlová geometrie
-Voda
-Oxid siřičitý, SO2
-Oxid dusičitý, NO2
-Ozon, O3
-Anion amiduro, NH2-
Trigonální letadlo
-Trifluorid bromitý, BF3
-Chlorid hlinitý, AlCl3
-Nitrátový anion, NO3-
-Uhličitan aniontový, CO32-
Tetrahedral
-Metanový plyn, CH4
-Tetrachlormethan, CCl4
-Kation amonný, NH4+
-Síran aniontový, SO42-
Trigonální pyramida
-Amoniak, NH3
-Kation hydronium, H3O+
Trigonální bipyramid
-Pentafluorid fosforečný, PF5
-Pentachlorid antimonitý, SbF5
Oscilace
Tetrafluorid síry, SF4
Tvar T
-Trichlorid jodu, ICl3
-Chlorid trifluorid, ClF3 (obě sloučeniny jsou známé jako interhalogeny)
Octahedral
-Hexafluorid síry, SF6
-Hexafluorid selenu, SeF6
-Hexafluorfosfát, PF6-
Kulminovat, molekulární geometrie je to, co vysvětluje pozorování chemických nebo fyzikálních vlastností hmoty. Je však orientována podle elektronické geometrie tak, že tato musí být vždy stanovena před první.
Odkazy
- Whitten, Davis, Peck & Stanley. Chemie (8. vydání). CENGAGE Learning, str. 194-198.
- Shiver a Atkins. (2008). Anorganická chemie (Čtvrté vydání, str. 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011). Molekulární geometrie a teorie VSEPR. Zdroj: nyu.edu
- Virtuální Chembook, Charles E. Ophardt. (2003). Úvod do molekulární geometrie. Zdroj: chemistry.elmhurst.edu
- Chemie LibreTexts. (8. září 2016). Geometrie molekul. Zdroj: chem.libretexts.org


