Chlorid cínu (SnCl2) Vlastnosti, struktura, použití a rizika
chlorid cínu (II) nebo chlorid cínatý, chemického vzorce SnCl2, je bílá krystalická pevná látka, produkt reakce cínu a koncentrovaného roztoku kyseliny chlorovodíkové: Sn (s) + 2HCl (konc.) => SnCl2(aq) + H2(g) Proces jeho syntézy (příprava) spočívá v přidávání kousků cínových pilin k reakci s kyselinou.
Po přidání kousků cínu se provede dehydratace a krystalizace, dokud se nezíská anorganická sůl. V této sloučenině, cín ztratil dva elektrony od jeho valence shell tvořit vazby s atomy chloru.
To lze lépe pochopit, pokud vezmeme v úvahu valenční konfiguraci cínu (5s)25px2stra0strz0), z toho pár elektronů zabírajících orbitál px je dán protonům H+, za účelem vytvoření diatomové molekuly vodíku. To je reakce redoxního typu.
Index
- 1 Fyzikální a chemické vlastnosti
- 1.1 Valencie
- 1.2 Reaktivita
- 1.3 Redukční aktivita
- 2 Chemická struktura
- 3 Použití
- 4 Rizika
- 5 Odkazy
Fyzikální a chemické vlastnosti
Spojení SnCl2 Jsou iontové nebo kovalentní? Fyzikální vlastnosti chloridu cínatého vylučují první možnost. Teplota tání a teploty varu této sloučeniny je 247 ° C a 623 ° C, což svědčí o slabých intermolekulárních interakcích, což je běžný fakt pro kovalentní sloučeniny..
Jeho krystaly jsou bílé, což se projevuje nulou absorpcí ve viditelném spektru.
Valencie konfigurace
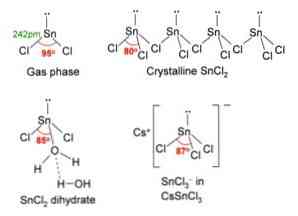
Na obrázku nahoře v levém horním rohu je znázorněna izolovaná molekula SnCl2.
Molekulární geometrie by měla být plochá, protože hybridizace centrálního atomu je sp2 (3 orbital sp2 a čistý p orbitál tvořit kovalentní vazby), ale volný pár elektronů zabírá objem a tlačí atomy chloru dolů, dávat molekulu úhlová geometrie.
V plynné fázi je tato sloučenina izolována, takže neinteraguje s ostatními molekulami.
Jako ztráta dvojice elektronů v orbitálu px, cín se přemění na iont Sn2+ a jeho výsledná elektronická konfigurace je 5s25px0stra0strz0, se všemi jeho p orbitály k dispozici přijmout odkazy z jiných druhů.
Ionty Cl- s iontem Sn2+ za vzniku chloridu cínatého. Elektronická konfigurace cínu v této soli je 5s25px2stra2strz0, schopnost přijmout další pár elektronů ve svém volném orbitálu pz.
Můžete například přijmout další iont Cl-, vytvoření komplexu trigonální geometrie roviny (pyramida s trojúhelníkovou základnou) a záporně nabitá [SnCl3]-.
Reaktivita
SnCl2 má vysokou reaktivitu a tendenci se chovat jako Lewisova kyselina (elektronový receptor) k dokončení valenčního oktetu.
Stejně jako přijímá iont Cl-, totéž se děje s vodou, která "hydratuje" atom cínu spojením molekuly vody přímo s cínem a druhá molekula vody tvoří interakce s vodíkovými vazbami s první.
Výsledkem je, že SnCl2 není čistá, ale koordinovaná s vodou ve své dihydrátované soli: SnCl22H2O.
SnCl2 Je velmi rozpustný ve vodě a v polárních rozpouštědlech, protože se jedná o polární sloučeninu. Nicméně jeho rozpustnost ve vodě, nižší než jeho hmotnostní hmotnost, aktivuje hydrolytickou reakci (prasknutí molekuly vody) za vzniku bazické a nerozpustné soli:
SnCl2(aq) + H2O (l) <=> Sn (OH) Cl (s) + HCl (aq)
Dvojitá šipka označuje, že je ustavena rovnováha, která je zvýhodněna vlevo (směrem k reaktantům), pokud koncentrace HCl vzrůstají. Pro tento účel byly použity roztoky SnCl2 mají kyselé pH, aby se zabránilo vysrážení nežádoucího solného produktu hydrolýzy.
Redukční aktivita
Reaguje s kyslíkem ve vzduchu za vzniku chloridu cínatého nebo chloridu cíničitého:
6 SnCl2(aq) + O2(g) + 2H2O (l) => 2SnCl4(aq) + 4Sn (OH) Cl (s)
V této reakci cín oxiduje za vzniku vazby s elektronegativním atomem kyslíku a zvyšuje počet vazeb s atomy chloru.
Obecně elektronegativní atomy halogenů (F, Cl, Br a I) stabilizují vazby sloučenin Sn (IV) a tato skutečnost vysvětluje, proč SnCl2 je to redukční činidlo.
Když oxiduje a ztrácí všechny své valenční elektrony, Sn ion4+ zůstává s konfigurací 5s05px0stra0strz0, být pár elektronů v orbitálu 5s nejtěžší být “snatched”.
Chemická struktura
SnCl2 představuje krystalovou strukturu ortorombického typu, podobnou řadám pil, ve kterých jsou zuby zubů chloridy.
Každý řádek je řetězec SnCl3 vytvoření můstku Cl s jiným atomem Sn (Cl-Sn (Cl)2-Cl- ···), jak je vidět na obrázku výše. Dva řetězce, spojené slabou interakcí typu Sn-Cl, tvoří jednu vrstvu uspořádání, která je navrstvena na jinou vrstvu, a tak dále, dokud není definována krystalická pevná látka..
Volný elektronový pár 5s2 způsobuje zkreslení struktury, protože zabírá objem (objem elektronického oblaku).
Sn může mít koordinační číslo rovné devíti, který je stejný jak mít devět sousedů, kreslit trigonální hranol s tímto umístěným ve středu geometrického obrazce a Cl v vrcholech, kromě jiného Cl lokalizovaný v každém. čtvercových ploch hranolu.
Toto je snadnější pozorovat jestliže jeden zvažuje řetěz kde Sn (tmavě šedé koule) směřují nahoru, a tři Cl spojený s tím tvořit trojúhelníkovou podlahu, zatímco tři horní Cls tvoří trojúhelníkovou střechu \ t.
Použití
V organické syntéze se používá jako redukční činidlo pro aromatické nitrosloučeniny (Ar-NO.)2 Ar-NH2). Protože jeho chemická struktura je laminární, nachází uplatnění ve světě katalýzy organických reakcí, kromě toho, že je potenciálním kandidátem na katalytickou podporu.
Jeho redukční vlastnosti se používají k určení přítomnosti sloučenin zlata, k potahování skel se stříbrnými zrcátky ak působení jako antioxidant.
Také, v jeho molekulární geometrii trigonální pyramida (: SnX3- M+) se používá jako Lewisova báze pro syntézu velkého počtu sloučenin (například komplexu Pt klastrů).3Sn8Cl20, kde pár bez elektronů je koordinován s Lewisovou kyselinou).
Rizika
SnCl2 Může poškodit bílé krvinky. Je korozivní, dráždivé, karcinogenní a má negativní negativní dopad na druhy, které obývají mořské ekosystémy.
Při vysokých teplotách se může rozkládat a uvolňovat škodlivý plynný chlor. Při styku s vysoce oxidačními činidly spouští výbušné reakce.
Odkazy
- Shiver a Atkins. (2008). Anorganická chemie In Prvky skupiny 14 (čtvrté vydání, strana 329). Mc Graw Hill.
- ChemicalBook. (2017). Citováno dne 21. března 2018, z ChemicalBook: chemicalbook.com
- PubChem. (2018). Chlorid cínu. Získaný 21. března 2018, od PubChem: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2017). Chlorid cínatý. Citováno dne 21. března 2018, z Wikipedie: en.wikipedia.org
- E. G. Rochow, E. W. (1975). Chemie germania: cín a olovo (první ed.). p-82.83. Pergamom Press.
- F. Hulliger. (1976). Strukturální chemie fázových fází. P-120,121. Vydavatelství D. Reidel.



