Vzorec kyseliny propanové, vlastnosti, rizika a použití
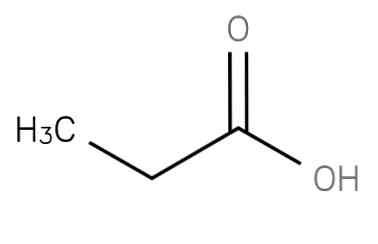
kyselina propanová "Alkylová skupina" je nasycená mastná kyselina s krátkým řetězcem obsahující ethan navázaný na uhlík karboxyskupiny. Jeho vzorec je CH3-CH2-COOH. Anion CH3CH2COO- stejně jako soli a estery kyseliny propanové jsou známy jako propionáty (nebo propanoáty)..
Může být získána z odpadní buničiny fermentačním procesem za použití bakterií rodu propionibacterium. Získává se také z ethanolu a oxidu uhelnatého za použití katalyzátoru fluoridu boritého (O'Neil, 2001)..
Další způsob, jak získat kyselinu propanovou, je oxidace propionaldehydu v přítomnosti iontů kobaltu nebo manganu. Tato reakce se vyvíjí rychle při teplotách až 40-50 ° C:
2CH3CH2CHO + O2 → 2CH3CH2COOH
Sloučenina je přirozeně přítomna v nízkých koncentracích v mléčných výrobcích a je vyráběna v obecné formě, spolu s dalšími mastnými kyselinami s krátkým řetězcem, v gastrointestinálním traktu lidí a jiných savců jako konečného produktu mikrobiálního štěpení sacharidů..
Má významnou fyziologickou aktivitu u zvířat (Human Metabolome Database, 2017).
Index
- 1 Fyzikální a chemické vlastnosti
- 2 Reaktivita a nebezpečí
- 3 Biochemie
- 4 Použití
- 5 Odkazy
Fyzikální a chemické vlastnosti
Kyselina propanová je bezbarvá a olejovitá kapalina s ostrým, nepříjemným a žluklým zápachem. Jeho vzhled je znázorněn na obrázku 2 (Národní centrum pro biotechnologické informace, 2017).

Kyselina propanová má molekulovou hmotnost 74,08 g / mol a hustotu 0,992 g / ml. Bod tuhnutí a bod varu je -20,5 ° C a 141,1 ° C. Kyselina propanová je slabá kyselina, jejíž pKa je 4,88.
Sloučenina je velmi rozpustná ve vodě, přičemž je schopna rozpouštět 34,97 g sloučeniny na 100 ml rozpouštědla. Je také rozpustný v ethanolu, etheru a chloroformu (Royal Society of Chemistry, 2015)..
Kyselina propanová má střední fyzikální vlastnosti mezi těmi menších karboxylových kyselin, kyseliny mravenčí a octové a větších mastných kyselin.
Ukazuje obecné vlastnosti karboxylových kyselin a může tvořit amidové, esterové, anhydridové a chloridové deriváty. Může se podrobit alfa-halogenaci bromem v přítomnosti PBr3 jako katalyzátoru (reakce HVZ) za vzniku CH3CHBrCOOH.
Reaktivita a nebezpečí
Kyselina propanová je hořlavý a hořlavý materiál. Může být zapálen teplem, jiskrami nebo plameny. Výpary mohou se vzduchem tvořit výbušné směsi, které jsou schopny cestovat ke zdroji zapálení a explodovat.
Většina par je těžší než vzduch. Budou se šířit po zemi a budou shromažďovány v nízkých nebo uzavřených prostorách (kanalizace, sklepy, nádrže). Nebezpečí výbuchu páry uvnitř, venku nebo v kanalizaci.
Látky označené písmenem (P) mohou explozivně polymerovat při zahřátí nebo zabalení do ohně. Kontejnery mohou při zahřátí explodovat (PROPIONIC ACID, 2016).
Sloučenina by měla být udržována mimo dosah tepla nebo zdrojů vznícení. Při zahřátí na rozklad vydává štiplavý kouř a dráždivé výpary.
Kyselina propanová dráždí kůži, oči, nos a hrdlo, ale nevyvolává akutní systémové účinky a nemá prokazatelný genotoxický potenciál. V případě kontaktu omýt velkým množstvím vody (Bezpečnostní list materiálu Propionová kyselina, 2013).
Biochemie
Konjugovaná báze kyseliny propanové, propionátu, je tvořena jako koncový fragment tří uhlíků (aktivovaných koenzymem A jako propionyl-CoA) v oxidaci nepárových uhlíkových mastných kyselin a oxidace postranního řetězce cholesterolu.
Experimenty s radioaktivními izotopy propionátu injektovaného na laktovaných potkanech ukazují, že se mohou objevit v glykogenu, glukóze, meziproduktech cyklu kyseliny citrónové, aminokyselin a proteinů..
Cesta metabolismu kyseliny propanové zahrnuje interakci s koenzymem A, karboxylací za vzniku methylmalonyl-koenzymu A a konverzí na kyselinu jantarovou, která vstupuje do cyklu kyseliny citrónové.
Kyselina propanová může být oxidována bez tvorby ketonových tělísek a na rozdíl od kyseliny octové je začleněna do uhlohydrátu i lipidu (Bingham, Cohrssen, & Powell, 2001)..
Propionová acidurie je jednou z nejčastějších organických acidurií, onemocnění, které zahrnuje mnoho různých poruch.
Výsledek pacientů narozených s propionickou acidurií je špatný ve vývoji intelektuálního vývoje, kdy 60% má IQ nižší než 75 a vyžaduje speciální vzdělání..
Úspěšné transplantace jater a / nebo ledvin u několika pacientů mají za následek lepší kvalitu života, ale nutně nezabraňují neurologickým a viscerálním komplikacím..
Tyto výsledky zdůrazňují potřebu trvalého sledování metabolismu, nezávisle na terapeutické strategii.
Použití
Kyselina propanová inhibuje růst bakterií a plísní v množství mezi 0,1 a 1% hmotnostními. Výsledkem je, že většina vyrobené kyseliny propanové je spotřebována jako konzervační látka jak pro krmiva, tak pro potraviny pro lidskou spotřebu, jako jsou obilí a obiloviny..
Zachování krmiv, obilovin a potravin, jakož i výroba propionátu vápenatého a sodíku, které v roce 2016 představují téměř 80% světové spotřeby kyseliny propanové, v porovnání se 78,5% v roce 2012.
Přibližně 51% světové spotřeby kyseliny propanové se používá pro výživu zvířat a konzervaci obilí, zatímco téměř 29% se používá při výrobě propionátů vápenatých a sodných, které se také používají v potravinářském a krmivářském průmyslu..
Dalšími důležitými trhy pro kyselinu propanovou jsou produkce herbicidů a diethylketonu. Aplikace s menším objemem zahrnují acetátpropionát celulózy, léčiva, estery rozpouštědel, ochucovadla a vonné látky, změkčovadla, barviva a pomocné textilní látky, kůže a gumy.
Poptávka po kyselině propanové závisí do značné míry na produkci krmiv a obilovin, po níž následují balené potraviny a pekárenské výrobky..
Významné jsou vyhlídky globálního růstu kyseliny propanové a jejích solí v krmivech pro zvířata / obilí a konzervaci potravin (IHS Markit, 2016)..
Jiné rychle rostoucí trhy zahrnují propionátové estery pro rozpouštědla, takový jako n-butyl propionate a pentyl; Tyto estery se stále častěji používají jako náhražky rozpouštědel uvedených jako nebezpečné látky znečišťující ovzduší.
Odkazy
- Bingham, E., Cohrssen, B., & Powell, C. (2001). Pattyho toxikologické svazky 1-9 5. vydání. New York: John Wiley & Sons.
- EMBL-EBI (2016, 14. října). kyseliny propionové. Obnoveno z ChEBI: ebi.ac.uk.
- Databáze lidského metabolomu. (2017, 2. března). Kyselina propionová. Zdroj: hmdb.ca: hmdb.ca.
- IHS Markit. (2016, prosinec). Chemická ekonomická příručka Propionová kyselina. Získáno z ihs: ihs.com.
- Materiálový bezpečnostní list Kyselina propionová. (2013, 21. května). Získané z sciencelab: sciencelab.com.
- Národní centrum pro biotechnologické informace ... (2017, 22. dubna). PubChem Compound Database; CID = 1032. Zdroj: pubchem.ncbi.nlm.nih.gov.
- O'Neil, M. ((2001), The Merck Index - Encyklopedie chemikálií, léků a biologů, 13. vydání, New Jersey: Merck and Co., Inc..
- KYSELINA PROPIONOVÁ. (2016). Získaný od cameochemicals: cameochemicals.noaa.gov.
- Královská chemická společnost. (2015). Kyselina propionová. Zdroj: chemspider: chemspider.com.


