Butinová struktura, vlastnosti a použití
butino je chemická sloučenina, která patří do skupiny alkynů, charakterizovaných hlavně tím, že má ve své struktuře alespoň trojnou vazbu mezi dvěma atomy uhlíku.
Pokud jde o stanovení pravidel pro označení alkynů, IUPAC (zkratka v angličtině pro International Union of Pure and Applied Chemistry) prokázala, že se používají stejně jako alkenes..

Základním rozdílem mezi názvoslovím obou typů látek je, že přípona -one se mění na -or, pokud jde o sloučeniny, které mají ve své struktuře trojné vazby..
Na druhé straně, butino je jen složeno z uhlíku a vodíku, a to přijde ve dvou formách: 1-butyne, který je v plynné fázi za standardních tlakových a teplotních podmínek (1 atm, 25 ° C); a 2-butino, což je druh kapalné fáze produkovaný chemickou syntézou.
Index
- 1 Chemická struktura
- 1.1 1-butino
- 1,2 2-butin
- 2 Vlastnosti
- 3 Použití
- 4 Odkazy
Chemická struktura
V molekule známé jako butino je prezentován fenomén strukturní izomerizace polohy, který spočívá v přítomnosti stejných funkčních skupin v obou sloučeninách, ale každá z nich je v jiném místě řetězce..
V tomto případě mají obě formy butinu stejný molekulární vzorec; nicméně, v 1-butyne trojitá vazba je lokalizována v uhlíkovém čísle jeden, zatímco v 2-butyne to je nalezené v čísle dva. To je převádí na polohové izomery.
Kvůli umístění trojité vazby v jednom z terminálů 1-butyne struktury, to je považováno za terminální alkyne, zatímco mezilehlá pozice trojité vazby v 2-butyne struktura dá tomu klasifikaci vnitřního alkyne \ t.
Spojení tedy může být pouze mezi prvním a druhým uhlíkem (1-butinem) nebo mezi druhým a třetím uhlíkem (2-butinem). Důvodem je aplikovaná nomenklatura, kde bude vždy možné co nejmenší číslování vždy přiřazeno pozici trojného vazby.
1-butino
Sloučenina nazvaná 1-butin je také známá jako ethylacetylen, protože má svou strukturu a způsob, jakým jsou uspořádány a vázány čtyři atomy uhlíku. Nicméně když mluvíme butino odkazujeme pouze na tento chemický druh.
V této molekule se trojitá vazba nachází v terminálním uhlíku, který umožňuje dostupnost atomů vodíku, které jí dávají velkou reaktivitu.
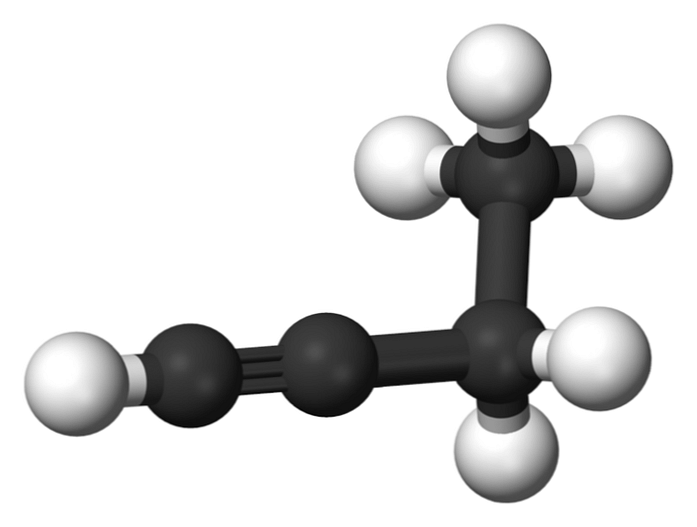
Tato tuhá a silnější vazba než jednoduchá nebo dvojná vazba mezi atomy uhlíku poskytuje stabilní konfiguraci 1-butinové lineární geometrie.
Na druhé straně je tato plynná látka velmi hořlavá, takže v přítomnosti tepla může snadno způsobit požáry nebo výbuchy a má velkou reaktivitu v přítomnosti vzduchu nebo vody..
2-butin
Protože vnitřní alkyny vykazují větší stabilitu než koncové alkyny, umožňují transformaci 1-butinu na 2-butyn.
K této izomeraci může dojít zahřátím 1-butinu v přítomnosti báze (jako je NaOH, KOH, NaOCH3 ...) nebo přesmykem 1-butinu v roztoku hydroxidu draselného (KOH) v ethanolu (C2H6O).
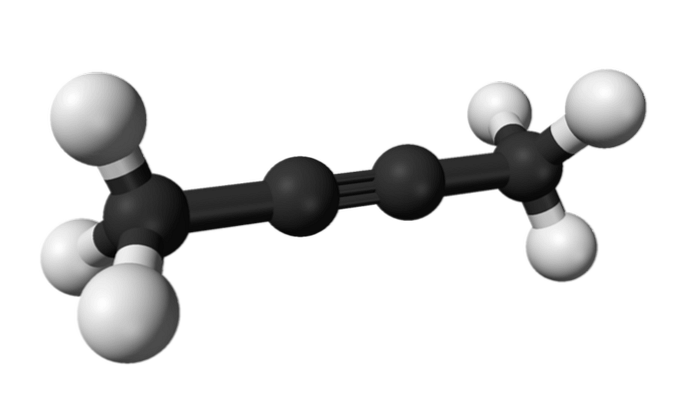
Stejně tak se chemická látka známá jako 2-butyn nazývá také dimethylacetylen (nebo krotonylen), který se prezentuje jako kapalný a těkavý druh, který vzniká uměle..
Ve 2-butynu je trojná vazba uprostřed molekuly, což jí dává větší stabilitu než její izomer.
Tato bezbarvá sloučenina má navíc nižší hustotu než voda, i když je v ní nerozpustná a má vysokou hořlavost..
Vlastnosti
-Strukturní vzorec butinu (bez ohledu na to, na který izomer se odkazuje) je C4H6, který má lineární strukturu.
-Jednou z chemických reakcí trpících molekulou butinu je izomerizace, při které dochází k přeskupení a migraci trojné vazby v molekule..
-1-Butin je v plynné fázi, má velmi vysokou hořlavost a vyšší hustotu než vzduch.
-Tato látka je také velmi reaktivní a v přítomnosti tepla může způsobit prudké výbuchy.
-Kromě toho, když tento bezbarvý plyn způsobí neúplnou reakci spalování, může způsobit oxid uhelnatý (CO).
-Pokud jsou oba izomery vystaveny vysokým teplotám, mohou nastat polymerační reakce s výbušným typem.
-2-butin je v kapalné fázi, i když je také považován za velmi hořlavý za standardních podmínek tlaku a teploty.
-Tyto látky se mohou vyskytovat v případě silných oxidačních látek.
-Stejně tak dochází k exotermním reakcím s následným uvolňováním plynného vodíku v přítomnosti redukujících druhů..
-Při kontaktu s některými katalyzátory (například s některými kyselými látkami) nebo se startovacími druhy mohou nastat exotermní polymerační reakce..
Použití
Protože mají některé odlišné vlastnosti, oba izomery mohou mít různá použití a použití, jak je uvedeno níže:
V první řadě je velmi často jedním z použití 1-butinu jeho použití jako mezistupně ve výrobním procesu jiných látek organické povahy syntetického původu..
Na druhé straně se tento chemický druh používá ve zpracovatelském průmyslu pryže a odvozených sloučenin; například, když chcete získat benzol.
Podobně se používá ve výrobním procesu široké škály plastových výrobků, stejně jako při výrobě mnoha polyethylenových látek považovaných za vysoce husté..
Také 1-butin se často používá jako složka pro řezání a svařování některých kovových slitin, včetně oceli (slitiny železa a uhlíku)..
V jiném smyslu se izomer 2-butinu používá v kombinaci s dalším alkynem, který se nazývá propin, při syntéze některých látek známých jako alkylované hydrochinony, když se provádí proces celkové syntézy a-tokoferolu (vitamin E)..
Odkazy
- Wikipedia. (s.f.). Butyne Zdroj: en.wikipedia.org
- Yoder, C. H., Leber P. A. a Thomsen, M. W. (2010). Most k organické chemii: Pojmy a názvosloví. Citováno z knih.google.co.ve
- Study.com. (s.f.). Butyn: Strukturní vzorec a izomery. Získané ze studia.
- PubChem. (s.f.). 1-Butin. Zdroj: pubchem.ncbi.nlm.nih.gov
- PubChem. (s.f.). 2-Butyn. Zdroj: pubchem.ncbi.nlm.nih.gov


