Teorie moře elektronů Základy, vlastnosti a nevýhody
elektronová teorie elektronů Jedná se o hypotézu, která vysvětluje výjimečný chemický jev, ke kterému dochází u kovových vazeb mezi prvky s nízkou elektronegativitou. Jedná se o sdílení elektronů mezi různými atomy spojenými kovovými vazbami.
Elektronická hustota mezi těmito spoji je taková, že elektrony jsou delokalizovány a tvoří „moře“, kde se volně pohybují. To může také být vyjádřeno kvantovou mechanikou: některé elektrony (obvykle jeden k sedm na atom) být uspořádán v orbitals s vícenásobnými centry, která jsou napnuta přes kovový povrch \ t.
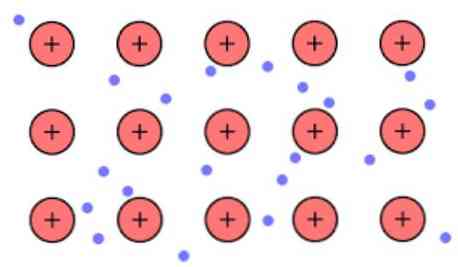
Také elektrony si zachovávají určité místo v kovu, ačkoli pravděpodobnostní rozdělení elektronického oblaku má vyšší hustotu kolem některých specifických atomů. To je dáno tím, že při použití určitého proudu vykazují svou vodivost ve specifickém směru.
Index
- 1 Základy teorie moře elektronů
- 2 Vlastnosti
- 2.1 Ofset ve formě vrstev
- 2.2 Teorie moře elektronů v kovových krystalech
- 3 Nevýhody teorie
- 4 Odkazy
Základy teorie moře elektronů
Kovové prvky mají velkou tendenci darovat elektrony z jejich poslední energetické úrovně (valenční vrstva), vzhledem k jejich ionizační energii tak nízké ve vztahu k ostatním prvkům.
Každý kovový prvek může být považován za kation vázaný k elektronu jeho poslední energetické úrovně, který by byl náchylnější k darování..
Jako v kovu máte velké množství atomů, které jsou spojeny dohromady, můžete předpokládat, že tento kov tvoří skupinu kovových kationtů, které jsou ponořeny do druhu moře valenčních elektronů, které mají velký offshoring..
Vzhledem k tomu, že elektrostatické přitažlivé síly, které existují mezi kationtem (kladným nábojem) a elektronem (záporný náboj) mají atomy kovu silně vázané, představuje delokalizaci valenčních elektronů, které se chovají jako elektrostatické lepidlo, které udržuje vazbu na kovové kationty.
Tímto způsobem lze vyvodit, že čím větší je počet elektronů přítomných ve valenční vrstvě kovu, tento druh elektrostatického lepidla bude mít větší pevnost.
Vlastnosti
Teorie moře elektronů nabízí jednoduché vysvětlení vlastností kovových druhů, jako je odpor, vodivost, tažnost a tvárnost, které se liší od jednoho kovu k druhému..
Bylo zjištěno, že rezistence vůči kovům je způsobena velkou delokalizací jejich elektronů, která vytváří velmi vysokou kohezní sílu mezi atomy, které ji tvoří.
Tímto způsobem je duktilita známa jako schopnost určitých materiálů umožnit deformaci jejich struktury, aniž by se dostaly k narušení, když jsou vystaveny určitým silám..
Offshoring ve formě vrstev
Jak duktilita, tak tvárnost kovu jsou dány skutečností, že valenční elektrony jsou delokalizovány ve všech směrech ve formě vrstev, což způsobuje, že se pohybují na sebe navzájem působením vnější síly, zabránění rozbití kovové konstrukce, ale umožnění její deformace.
Stejně tak svoboda pohybu delokalizovaných elektronů umožňuje tok elektrického proudu, což činí kovy velmi dobrou vodivostí elektřiny..
Navíc tento jev volného pohybu elektronů umožňuje přenos kinetické energie mezi různými oblastmi kovu, což podporuje přenos tepla a způsobuje, že kovy vykazují vysokou tepelnou vodivost..
Teorie moře elektronů v kovových krystalech
Krystaly jsou tuhé látky, které mají fyzikální a chemické vlastnosti - jako je hustota, bod tání a tvrdost - které jsou určeny druhem sil, které dělají částice, které je činí spolu,.
Svým způsobem se má za to, že krystaly kovového typu mají nejjednodušší struktury, protože každý "bod" krystalové sítě byl obsazen atomem samotného kovu..
V tomto smyslu bylo zjištěno, že struktura kovových krystalů je obecně kubická a zaměřuje se na plochy nebo tělo.
Tyto druhy však mohou mít také šestiúhelníkový tvar a mají poměrně kompaktní balení, což jim dává obrovskou hustotu, která je charakteristická pro.
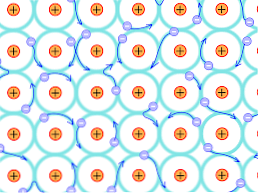
Kvůli tomuto konstrukčnímu důvodu jsou vazby, které se tvoří v kovových krystalech, odlišné od vazeb, které se vyskytují v jiných druzích krystalů. Elektrony, které mohou tvořit vazby, jsou delokalizovány v krystalické struktuře, jak bylo vysvětleno výše.
Nevýhody teorie
V kovových atomech je malé množství valenčních elektronů v poměru k jejich energetickým úrovním; to je, tam je větší množství dostupných energetických stavů než množství elektronů spojených.
To znamená, že jelikož existuje silná elektronická delokalizace a také energetické pásy, které byly částečně zaplněny, elektrony se mohou pohybovat přes retikulární strukturu, když jsou vystaveny elektrickému poli přicházejícímu zvenčí, kromě toho, že tvoří oceán elektronů. podporuje propustnost sítě.
Spojení kovů je tedy interpretováno jako konglomerát kladně nabitých iontů spojených mořem elektronů (záporně nabitých).
Existují však charakteristiky, které tento model nevysvětluje, jako například tvorba určitých slitin mezi kovy se specifickými kompozicemi nebo stabilita kolektivních kovových spojů..
Tyto nevýhody jsou vysvětleny kvantovou mechanikou, protože jak tato teorie, tak mnoho dalších přístupů byly založeny na nejjednodušším modelu jediného elektronu, zatímco se pokoušely aplikovat mnohem složitější struktury víceúrovňových atomů..
Odkazy
- Wikipedia. (2018). Wikipedia. Zdroj: en.wikipedia.org
- Holman, J. S. a Stone, P. (2001). Chemie Citováno z knih.google.co.ve
- Parkin, G. (2010). Kovové lepení kovů. Citováno z knih.google.co.ve
- Rohrer, G. S. (2001). Struktura a vazba v krystalických materiálech. Citováno z knih.google.co.ve
- Ibach, H. a Lüth, H. (2009). Fyzika pevných látek: Úvod do principů materiálových věd. Citováno z knih.google.co.ve


