Sulfid železitý (II) Vlastnosti, rizika a použití
sirník železitý (II), také nazývaný sulfid železnatý, je chemická sloučenina vzorce FeS. Prášek sulfid železitý je pyroforický (vznítí spontánně ve vzduchu).
Sulfidové železo (II) se získává zahříváním síry a železa podle reakce:
Fe + S → FeS
Reakce je velmi exotermická (uvolňuje teplo) a poměr železa a síry by měl být 7: 4 (NileRed, 2014).
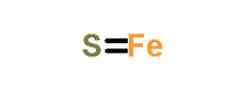
Sulfid železitý lze také získat ve vodném médiu rozpuštěním síry v iontovém roztoku železa (II). Síra, když je rozpuštěna, tvoří sirovodík, který podle reakce reaguje reverzibilně s ionty železa (II)
Víra2+ + H2S FeS (s) + 2H+
Tato reakce však soutěží s reakcí tvorby síranu železnatého (II) následujícím způsobem:
Víra2+ + 2HS- → Fe (HS)2(s)
Následně se síran železnatý (II) rozkládá na síran železnatý, i když reakce probíhá velmi pomalu (Rickard, 1995)..
Index
- 1 Fyzikální a chemické vlastnosti
- 2 Reaktivita a nebezpečí
- 3 Manipulace a skladování
- 4 Použití
- 5 Odkazy
Fyzikální a chemické vlastnosti
Sírovodík železitý (II) je tmavě hnědá nebo černá kovově vypadající pevná látka. Když je čistý, je bezbarvý (National Center for Biotechnology Information, S.F.). Obrázek 2 znázorňuje vzhled sulfidu železnatého.

Sloučenina má molekulovou hmotnost 87,910 g / mol a hustotu 4,84 g / ml. Má bod tání 1195 ° C a je nerozpustný ve vodě a kyselině dusičné (Royal Society of Chemistry, 2015).
Sulfid železitý reaguje v kyselém prostředí za vzniku par oxidu železitého a sirovodíku, které jsou extrémně toxické. To je pozorováno v následující reakci:
FeS + 2H+ → Víra2+ + H2S
Reakce se zředěnými roztoky kyseliny sírové za vzniku oxidu železitého, oxidu siřičitého a vody podle reakce:
FeS + H2SO4 → FeO + H2O + SO2
Reaktivita a nebezpečí
Sulfid železitý je nestabilní sloučenina a reaguje se vzduchem za vzniku oxidu železitého a síry. Sloučenina je pyroforická a může se spontánně vznítit nebo také produktem silného nárazu, proto se nedoporučuje mletí v maltě, když je syntetizována a musí být ošetřena opatrně..
Reaguje s oxidačními činidly a při zahřátém rozkladu vznikají toxické výpary oxidů síry. Sloučenina je velmi nebezpečná v případě požití a v případě kontaktu s očima (dráždivý) a vdechování nebezpečný (Bezpečnostní list materiálu Ferid sulfidu, 2013).
V případě kontaktu s očima je třeba je vypláchnout velkým množstvím vody po dobu nejméně 15 minut, občas nadzvednout horní a dolní víčko..
Pokud se látka dostane do styku s kůží, měla by být opláchnuta dostatečným množstvím vody po dobu nejméně 15 minut při odstraňování kontaminovaného oblečení a obuvi..
Pokud je oběť při požití vědomá a ostražitá, měl by dostat 2-4 šálků mléka nebo vody. Osobě v bezvědomí nikdy nedávejte nic ústy
V případě nadýchání by měl být oběť vyjmuta z místa expozice a přemístěna na chladné místo. Pokud nedýchá, má se podat umělé dýchání. Pokud je dýchání obtížné, je třeba podat kyslík.
Ve všech případech je nutné získat okamžitou lékařskou pomoc (fisher scientific, 2009)..
Sulfid železa se podílí na vzácném benigním stavu známém jako pseudomelanáza duodeni. To se endoskopicky projevuje jako diskrétní, ploché, černohnědé skvrny v duodenální sliznici.
Nevyvolává příznaky a může být reverzibilní. S elektronovou mikroskopií a rentgenovou analýzou energetické disperze elektronovou sondou pigment odpovídá především akumulaci sulfidu železitého (FeS) v makrofágech v lamina propria (Cheng CL, 2000).
Manipulace a skladování
Sulfid železitý by měl být uchováván mimo dosah tepla a zdrojů vznícení. Prázdné nádoby představují nebezpečí požáru, odpad musí být odpařen pod odsavačem. Uzemněte všechna zařízení obsahující materiál, aby se zabránilo elektrickým jiskrám.
Nevdechujte prach. Zabraňte kontaktu s očima. Používejte vhodný ochranný oděv. V případě nedostatečného větrání používejte vhodné vybavení pro ochranu dýchacích orgánů.
Pokud se necítíte dobře, měli byste vyhledat lékařskou pomoc a ukázat etiketu produktu co nejvíce. Sloučenina by měla být uchovávána mimo dosah nekompatibilních látek, jako jsou oxidační činidla a kyseliny.
Nádoba obsahující sloučeninu by měla být udržována v suchu na chladném místě. A musí být hermeticky uzavřen na větraném místě. Hořlavé materiály by měly být skladovány mimo extrémní teplo a mimo dosah silných oxidačních činidel.
Použití
Sulfid železa se používá v průmyslu slitin a korozivzdorných ocelí ke kontrole křehnutí vodíku. Železný a ocelářský průmysl používá sulfid železa jako re-sířovací činidlo při výrobě uhlíkových, slitinových a nerezových ocelí..
Působí také jako degradační činidlo pro zlepšení kapacity ocelového licího stroje, které se používá při výrobě různých ocelových dílů. Při čištění surové kyseliny fosforečné se jako redukční činidlo používá sulfid železa k odstranění těžkých nečistot z kyseliny fosforečné.
Další použití sulfidu železa je ve výrobě tvárné litiny. Sulfid železa kombinovaný se železným křemíkem a feromanganem se používá ke zvýšení obsahu síry v oceli a železu.
Sulfid železa se také používá jako laboratorní chemikálie pro přípravu sirovodíkového plynu. Jako barvivo se používá barviva na vlasy, barvy, keramika, lahve a sklenice. Používá se také v mazivech a při zpracování výfukových plynů.
Sulfid železa má kompatibilní použití se sulfáty. Sulfátové sloučeniny jsou rozpustné ve vodě a používají se při úpravě vody. Sulfid železa se také používá při výrobě kovových odlitků.
Sulfid železa je minerální pyrit, který se podobá zlatu a je přezdíván jako "zlato blázna". Pyrit se používá při výrobě síry a kyseliny sírové a používá se také při těžbě uhlí (JAINSON LABS (INDIA), S.F.).
Odkazy
- Cheng CL, e. a. (2000). Pseudomelanosis duodeni: kazuistika. Changgeng Yi Xue Za Zhi 23 (6), 372-376.
- vědeckého rybáře (2009, 20. srpna). Bezpečnostní list materiálu Železo (II) Sulfid. Získáno z lasecsa.
- JAINSON LABS (INDIA). (S.F.). Použití síranu železitého. Získáno z jainsonfes.
- Bezpečnostní list materiálu Sulfid železitý. (2013, 21. května). Získáno z sciencelab.
- Národní centrum pro biotechnologické informace. (S.F.). PubChem Compound Database; CID = 14828. Získáno z PubChem.
- (2014, 15. května). Příprava sulfidu železitého (II) (chladná reakce). Citováno z youtube.
- Rickard, D. (1995). Kinetika srážení FeS: Část 1. Konkurenční mechanismy reakce. Geochimica et Cosmochimica Acta, svazek 59, číslo 21, 4367-4379.
- Královská chemická společnost. (2015). Sírovodík železitý. Zdroj: chemspider: chemspider.com.


