Chemická aktivace energie Co se skládá z výpočtu
chemická aktivační energie (z hlediska kinetických studií) se týká nejmenšího možného množství energie potřebné k zahájení chemické reakce. Podle teorie kolizí v chemické kinetice se říká, že všechny molekuly, které jsou v pohybu, mají určité množství kinetické energie.
To znamená, že čím větší je rychlost vašeho pohybu, tím větší je velikost vaší kinetické energie. V tomto smyslu, molekula, která nese rychlý pohyb nemůže být rozdělena do fragmentů sám, tak srážka musí nastat mezi tím a jinou molekulou tak že chemická reakce může nastat..
Když se to stane - když nastane kolize mezi molekulami - zlomek její kinetické energie se přemění na vibrační energii. Podobně, jestliže na začátku procesu je kinetická energie vysoká, molekuly, které se účastní kolize, budou představovat vibraci tak velkou, že některé přítomné chemické vazby budou rozbité..
Toto rozdělení vazeb je prvním krokem v transformaci reaktantů na produkty; to znamená, že je tvoří. Na druhé straně, pokud na začátku tohoto procesu má kinetická energie malou velikost, bude existovat fenomén "odrazu" molekul, skrze který budou prakticky neporušeny..
Index
- 1 Z čeho se skládá??
- 1.1 Aktivovaný komplex
- 2 Jak se vypočítá?
- 2.1 Výpočet aktivační energie chemické reakce
- 3 Jak ovlivňuje aktivační energie rychlost reakce?
- 4 Příklady výpočtu aktivační energie
- 5 Odkazy
Z čeho se skládá??
Počínaje konceptem kolizí mezi molekulami, aby se iniciovaly chemické reakce popsané výše, lze říci, že existuje minimální množství energie potřebné pro kolizi..
Pokud je tedy energetická hodnota menší než toto nezbytné minimum, pak se mezi molekulami po kolizi prostě nevyskytne žádná změna, což znamená, že když tato energie chybí, zůstanou tyto druhy prakticky neporušené a nebudou se vyskytovat. jakékoli změny způsobené tímto šokem.
V tomto pořadí myšlenek, minimální energie, která je potřebná pro změnu nastávat po srážce mezi molekulami je volána aktivační energie.
Jinými slovy, molekuly zapojené do šoku musí mít množství celkové kinetické energie s velikostí rovnou nebo větší než aktivační energie, takže může dojít k chemické reakci..
Také, v mnoha případech molekuly se srazí a vzniknou nový druh volal aktivovaný komplex, struktura, která je také nazývána “přechodným stavem” protože to jen existuje dočasně \ t.
Je způsobena druhem reaktantu v důsledku kolize a před tvorbou produktů reakce.
Aktivovaný komplex
Uvedený aktivovaný komplex tvoří druh, který má velmi nízkou stabilitu, ale který má zase velké množství potenciální energie.
Následující diagram ukazuje přeměnu reaktantů na produkty, vyjádřených jako energie a poznamenávající, že velikost energie vytvořeného aktivovaného komplexu je podstatně větší než velikost reaktantů a produktů..
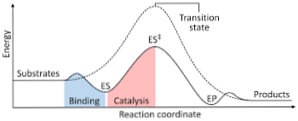
Pokud mají produkty na konci reakce větší stabilitu než reaktantní látky, dochází k uvolňování energie ve formě tepla, což vede k exotermní reakci..
Naopak, pokud mají reaktanty za následek stabilitu větší velikosti než produkty, znamená to, že reakční směs projevuje absorpci energie ve formě tepla ze svého okolí, což má za následek endotermní reakci..
Podobně, pokud dojde k jednomu případu nebo jinému případu, musí být vytvořen diagram, například ten, který byl dříve ukázán, kde je vynesena potenciální energie systému, která reaguje proti průběhu nebo průběhu reakce..
Tímto způsobem se získají potenciální změny energie, ke kterým dochází při probíhající reakci, a reaktanty se transformují na produkty.
Jak se vypočítá?
Aktivační energie chemické reakce je úzce spjata s konstantou rychlosti této reakce a závislost této konstanty na teplotě je vyjádřena Arrheniovou rovnicí:
k = Ae-Ea / RT
V tomto výrazu k představuje rychlostní konstantu reakce (která závisí na teplotě) a parametru A je to tzv. frekvenční faktor a je to míra četnosti kolizí mezi molekulami.
Z jeho strany, e vyjadřuje základ řady přirozených logaritmů. Je zvýšena na výkon rovnající se negativnímu kvocientu aktivační energie (Ea) mezi produktem plynoucím z konstanty plynu (R) a absolutní teplotu (T) systému, který má zvážit.
Je třeba poznamenat, že frekvenční faktor může být považován za konstantní v určitých reakčních systémech v širokém teplotním rozsahu.
Tento matematický výraz původně předpokládal chemik nizozemského původu Jacobus Henricus van't Hoff v roce 1884, ale kdo mu dal vědeckou platnost a interpretoval jeho premisu, byl švédský chemik Svante Arrhenius, v roce 1889.
Výpočet aktivační energie chemické reakce
Arrheniova rovnice poukazuje na přímou proporcionalitu, která existuje mezi konstantou rychlosti reakce a četností střetů mezi molekulami..
Rovněž tato rovnice může být reprezentována vhodnějším způsobem použitím vlastnosti přirozených logaritmů na každou stranu rovnice, čímž získáte:
ln k = ln A - Ea / RT
Při přeskupování termínů za účelem získání rovnice přímky (y = mx + b) je dosaženo následujícího výrazu:
ln k = (- Ea / R) (1 / T) + ln A
Při konstrukci grafu ln k versus 1 / T získáme přímku, kde ln k představuje souřadnici y, (- A / R) představuje sklon čáry (m), (1 / T) představuje souřadnici x a ln A představuje průsečík s osou souřadnic (b).
Jak je vidět, sklon vyplývající z tohoto výpočtu je roven hodnotě -Ea / R. To znamená, že je-li žádoucí získat hodnotu aktivační energie prostřednictvím tohoto výrazu, mělo by být provedeno jednoduché zúčtování, které má za následek:
Ea = -mR
Zde víme, že hodnota m a R je konstanta rovna 8,314 J / K · mol.
Jak ovlivňuje aktivační energie rychlost reakce?
Když se pokoušíte vytvořit obraz aktivační energie, lze ji považovat za bariéru, která neumožňuje, aby došlo k reakci mezi nižšími molekulami energie..
Jako v běžné reakci se stává, že počet molekul, které mohou reagovat, je poměrně velký, rychlost - a ekvivalentně kinetická energie těchto molekul - může být velmi variabilní.
Obvykle se stává, že pouze malé množství všech molekul, které prožijí kolizi - ty, které mají větší rychlost pohybu - představují dostatečnou kinetickou energii, aby mohly překonat velikost aktivační energie. Tyto molekuly jsou tedy vhodné a schopné být součástí reakce.
Podle Arrheniovy rovnice, záporné znaménko - které předchází kvocientu mezi aktivační energií a produktem konstanty plynu absolutní teplotou - znamená, že konstanta rychlosti klesá, protože dochází ke zvýšení aktivační energie, stejně jako růst, když se teplota zvyšuje.
Příklady výpočtu aktivační energie
Pro výpočet aktivační energie vytvořením grafu, podle Arrheniovy rovnice, máme, že rychlostní konstanty pro rozkladnou reakci acetaldehydu byly měřeny při pěti různých teplotách a chceme určit aktivační energii pro reakci, která je vyjádřena jako:
CH3CHO (g) → CH4(g) + CO (g)
Data z těchto pěti měření jsou následující:
k (1 / M1/2S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
Za prvé, abychom tento neznámý vyřešili a určili aktivační energii, musíme vytvořit graf ln k vs 1 / T (y vs x), abychom získali přímku a odtud vezměte svah a zjistěte hodnotu Ea, jak je vysvětleno.
Transformace dat měření, podle Arrheniovy rovnice [ln k = (- Ea / R) (1 / T) + ln A] jsou následující hodnoty pro y a x, resp.
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Z těchto hodnot a matematickým výpočtem svahu - buď v počítači, nebo v kalkulačce, pomocí výrazu m = (Y2-Y1) / (X2-X1) nebo metodou lineární regrese - získáme, že m = -Ea / R = -2,09 * 104 K. Takže:
Ea = (8,314 J / K · mol) (2,09 x 10%)4 K)
= 1,74 * 105 = 1,74 * 102 kJ / mol
Pro určení dalších energií aktivace grafickým způsobem se provede obdobný postup.
Odkazy
- Wikipedia. (s.f.). Aktivační energie. Zdroj: en.wikipedia.org
- Chang, R. (2007). Chemie, deváté vydání. Mexiko: McGraw-Hill.
- Britannica, E. (s.f.). Aktivační energie. Získáno z britannica.com
- Moore, J. W. a Pearson, R.G. (1961). Kinetika a mechanismus. Citováno z knih.google.co.ve
- Kaesche, H. (2003). Koroze kovů: Fyzikálně-chemické principy a současné problémy. Citováno z knih.google.co.ve


