Historie kalorimetru, části, typy a jejich vlastnosti
kalorimetr je zařízení, které se používá k měření změny teploty množství látky (obvykle vody) známého specifického tepla. Tato změna teploty je způsobena teplem absorbovaným nebo uvolněným v průběhu studovaného procesu; chemická, pokud se jedná o reakci, nebo fyzikální, pokud se skládá ze změny fáze nebo stavu.
V laboratoři je nejjednodušší kalorimetr, jaký je šálek kávy. Používá se k měření tepla absorbovaného nebo uvolněného při reakci při konstantním tlaku ve vodném roztoku. Reakce se volí tak, aby se zabránilo zásahu činidel nebo plynných produktů.
 Při exotermní reakci může být množství uvolněného tepla vypočítáno ze zvýšení teploty kalorimetru a vodného roztoku:
Při exotermní reakci může být množství uvolněného tepla vypočítáno ze zvýšení teploty kalorimetru a vodného roztoku:
Množství tepla, které se uvolňuje v reakci = množství tepla absorbovaného kalorimetrem + množství tepla absorbovaného roztokem
Množství tepla absorbovaného kalorimetrem se nazývá kalorimetrický kalorický výkon. To se stanoví dodáním známého množství tepla do kalorimetru daným množstvím vody. Pak se změří zvýšení teploty kalorimetru a roztok, který obsahuje.
S těmito údaji a použitím specifického tepla vody (4,18 J / g.ºC) lze vypočítat kalorickou kapacitu kalorimetru. Tato kapacita se také nazývá kalorimetrová konstanta.
Na druhé straně, teplo získané vodným roztokem se rovná m · ce · At. Ve vzorci m = hmotnost vody, ce = měrné teplo vody a Δt = změna teploty. Když to všechno víme, můžeme vypočítat množství tepla uvolněného exotermickou reakcí.
Index
- 1 Historie kalorimetru
- 2 Díly
- 3 Typy a jejich vlastnosti
- 3.1 Šálek kávy
- 3.2 Kalorimetrické čerpadlo
- 3.3 Adiabatický kalorimetr
- 3.4 Isoperibolický kalorimetr
- 3.5 Průtokový kalorimetr
- 3.6 Kalorimetr pro diferenciální skenovací kalorimetrii
- 4 Aplikace
- 4.1 Ve fyzikálně-chemické oblasti
- 4.2 V biologických systémech
- 4.3 Kalorimetr kyslíkové pumpy a kalorický výkon
- 5 Odkazy
Historie kalorimetru
V roce 1780, A. L. Lavoisier, francouzský chemik, považován za jednoho z otců chemie, používal morče k měření produkce tepla jeho dýcháním.
Jak? Použití zařízení podobného kalorimetru. Teplo produkované morčatem bylo prokázáno tavením sněhu, který obklopoval přístroj.
Výzkumníci A. L Lavoisier (1743-1794) a P. S. Laplace (1749-1827) navrhli kalorimetr, který byl použit pro měření specifického tepla těla metodou tavení ledu.
Kalorimetr se skládal z pocínované válcové kádinky, lakované, držené stativem a vnitřně zakončené nálevkou. Uvnitř bylo umístěno další sklo, podobné předchozímu, trubkou, která prošla vnější komorou a která byla opatřena klíčem. Uvnitř druhého skla byla mřížka.
V této mřížce byla umístěna bytost nebo objekt, jehož specifické teplo bylo žádoucí určit. Led byl umístěn uvnitř soustředných nádob, stejně jako v koši.
Teplo produkované tělem bylo absorbováno ledem, což způsobilo jeho roztavení. Tekutý vodní produkt tání ledu se shromáždil a otevřel klíč vnitřního skla.
A konečně, vážení vody, hmotnost roztaveného ledu byla známa.
Části
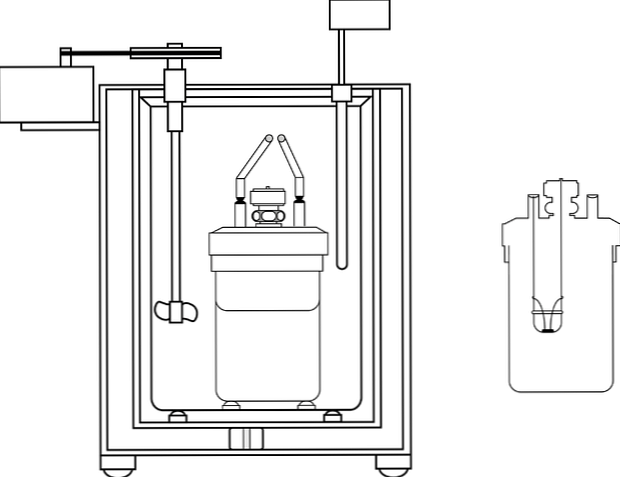
Nejčastěji používaným kalorimetrem v laboratořích pro výuku chemie je tzv. Kalorimetr kávového šálku. Tento kalorimetr se skládá z kádinky nebo místo toho nádoby z anime materiálu, která má určité izolační vlastnosti. Uvnitř této nádoby je vodný roztok umístěn s tělem, které produkuje nebo absorbuje teplo.
V horní části kontejneru je umístěn kryt izolačního materiálu se dvěma otvory. V jednom je teploměr zaveden pro měření teplotních změn a ve druhém je míchadlo, s výhodou ze skleněného materiálu, které plní funkci pohybu obsahu vodného roztoku..
Obrázek zobrazuje části kalorimetrického čerpadla; lze však pozorovat, že má teploměr a míchadlo, společné prvky v několika kalorimetrech.
Typy a jejich vlastnosti
Šálek kávy
Je to ten, který se používá při určování tepla uvolňovaného exotermickou reakcí a tepla absorbovaného v endotermní reakci..
Kromě toho může být použit při určování specifického tepla tělesa; to znamená množství tepla, které potřebuje gram látky absorbovat, aby zvýšila svou teplotu o jeden stupeň Celsia. .
Kalorimetrické čerpadlo
Je to zařízení, ve kterém se měří množství tepla, které se uvolňuje nebo absorbuje v reakci, ke které dochází při konstantním objemu.
Reakce probíhá v silné ocelové nádobě (čerpadlo), která je ponořena do velkého objemu vody. Díky tomu jsou změny teploty vody malé. Proto se předpokládá, že změny spojené s reakcí se měří při konstantní teplotě a objemu.
Z výše uvedeného vyplývá, že při provádění reakce v kalorimetrickém čerpadle není prováděna žádná práce.
Reakce začíná dodávkou elektřiny přes kabely připojené k čerpadlu.
Adiabatický kalorimetr
Vyznačuje se izolační strukturou zvanou štít. Stínění je umístěno kolem článku, kde dochází ke změnám teploty a teploty. Je také připojen k elektronickému systému, který udržuje svou teplotu velmi blízkou teplotě buňky, aby se zabránilo přenosu tepla.
V adiabatickém kalorimetru je teplotní rozdíl mezi kalorimetrem a jeho okolím minimalizován; a také minimalizaci koeficientu prostupu tepla a doby výměny tepla.
Jeho části se skládají z následujících částí:
-Buňka (nebo kontejner) je integrována do izolačního systému, kterým se snaží zabránit tepelným ztrátám.
-Teploměr pro měření teplotních změn.
-Ohřívač, připojený k regulovatelnému zdroji elektrického napětí.
-A ten štít, již zmíněný.
V tomto typu kalorimetru lze určit vlastnosti jako entropie, Debyeho teplota a elektronická hustota.
Isoperibolický kalorimetr
Je to zařízení, ve kterém jsou reakční buňka a čerpadlo ponořeny do struktury zvané plášť. V tomto případě se takzvaný plášť skládá z vody, udržované na konstantní teplotě.
Teplota článku a čerpadla stoupá, jakmile se během spalování uvolňuje teplo; ale teplota vodního pláště je udržována na pevné teplotě.
Mikroprocesor řídí teplotu článku a pláště a provádí nezbytné korekce úniku tepla, které vyplývají z rozdílů mezi oběma teplotami..
Tyto korekce jsou aplikovány průběžně as konečnou korekcí, založené na měřeních před a po zkoušce.
Průtokový kalorimetr
Vyvinut Caliendar, má zařízení pro pohyb plynu v kontejneru konstantní rychlostí. Při přidávání tepla se měří zvýšení teploty v tekutině.
Průtokový kalorimetr je charakterizován:
- Přesné měření konstantního průtoku.
- Přesné měření množství tepla přiváděného do kapaliny přes ohřívač.
- Přesné měření zvýšení teploty plynu způsobené vstupem energie
- Konstrukce pro měření kapacity plynu pod tlakem.
Kalorimetr pro diferenciální skenovací kalorimetrii
Vyznačuje se tím, že má dva zásobníky: v jednom je umístěn vzorek, který má být studován, zatímco druhý je ponechán prázdný nebo je použit referenční materiál..
Dvě nádoby se zahřívají konstantní rychlostí energie pomocí dvou nezávislých ohřívačů. Když začne ohřívání obou nádob, počítač bude zobrazovat graf rozdílu tepelného toku ohřívačů proti teplotě, čímž bude schopen určit tok tepla.
Kromě toho může být určena změna teploty jako funkce času; a konečně kalorická kapacita.
Aplikace
Ve fyzikální chemii
-Základní kalorimetry typu šálek kávy umožňují měřit množství tepla, které tělo uvolňuje nebo absorbuje. Mohou určit, zda je reakce exotermní nebo endotermní. Navíc může být určeno specifické teplo tělesa.
-S adiabatickým kalorimetrem bylo možné určit entropii chemického procesu a elektronickou hustotu stavu.
V biologických systémech
-Mikrokalorimetry se používají ke studiu biologických systémů, které zahrnují interakce mezi molekulami, jakož i změny molekulárních konformací, ke kterým dochází; například při rozvinutí molekuly. Linka zahrnuje jak diferenciální skenování, tak izotermickou titraci.
-Mikroklorimetr se používá při vývoji léků malých molekul, bioterapeutik a vakcín.
Kalorimetr s kogeneračním čerpadlem a kalorický výkon
Spalování mnoha látek probíhá v kalorimetru kyslíkové pumpy a lze stanovit jeho kalorickou energii. Mezi látkami zkoumanými použitím tohoto kalorimetru patří: uhlí a koks; jedlé oleje, těžké i lehké; benzín a všechna motorová paliva.
Stejně jako typy paliv pro letecké reaktory; Odpad z paliv a likvidace odpadu; potravinové výrobky a doplňky stravy pro lidskou výživu; Pícniny a potravinové doplňky; Stavební materiály; pohonných hmot.
Podobně kalorická energie byla stanovena kalorimetricky v termodynamických studiích hořlavých materiálů; ve studiu energetické bilance v ekologii; ve výbušninách a tepelných prášcích a ve výuce základních termodynamických metod.
Odkazy
- Whitten, Davis, Peck & Stanley. Chemie (8. vydání). CENGAGE Učení.
- González J., Cortés L. & Sánchez A. (s.f.). Adiabatická kalorimetrie a její aplikace. Obnoveno z: cenam.mx
- Wikipedia. (2018). Kalorimetr. Zdroj: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22. června 2018). Definice kalorimetru v chemii. Citováno z: thoughtco.com
- Gillespie, Claire. (11. dubna 2018). Jak funguje kalorimetr? Sciencing. Zdroj: sciencing.com


