Charakteristické vlastnosti hmoty (fyzikální a chemické)
charakteristické vlastnosti hmoty jsou to chemické nebo fyzikální vlastnosti, které mohou pomoci identifikovat nebo odlišit jednu látku od druhé. Fyzikální vlastnosti jsou vlastnosti látky, které jsou pozorovány smysly. Chemické vlastnosti jsou vlastnosti, které popisují, jak se látka během chemické reakce mění z jedné látky na druhou.
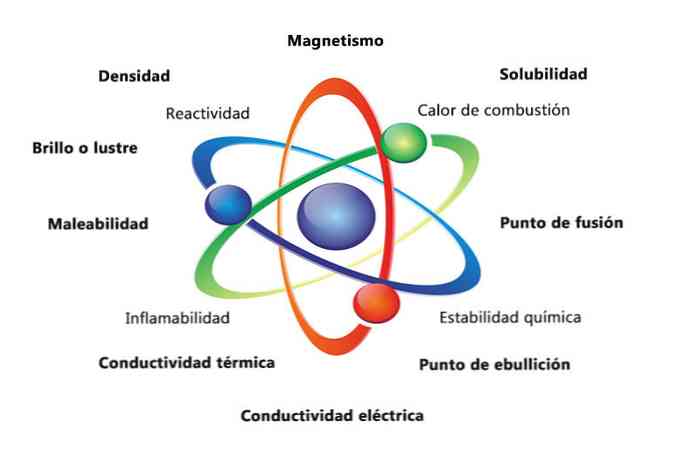
Některé fyzikální vlastnosti látky jsou hustota, rozpustnost, teplota tání, barva a hmotnost. Chemické vlastnosti materiálu zahrnují hořlavost, reaktivitu s kyselinami a korozi. Některé příklady toho, jak mohou vlastnosti hmoty pomoci určit prvek, je porovnat hustoty různých prvků.
Prvek jako zlato má hustotu 19,3 gramů na centimetr krychlový, zatímco hustota síry je 1,96 gramů na centimetr krychlový. Podobně se liší teploty tání látek, jako je voda a isopropylalkohol.
Fyzikální vlastnosti hmoty
Fyzikální vlastnosti hmoty jsou vlastnosti, které mohou být měřeny nebo pozorovány bez změny chemické povahy látky. Některé příklady fyzikálních vlastností jsou:
- Hustota: množství hmoty, která má předmět, se vypočítá dělením hmotnosti podle objemu.
- Magnetismus: síla přitažlivosti mezi magnetem a magnetickým předmětem.
- Rozpustnost: míra rozpustnosti látky v jiné látce.
- Bod tání: teplota, při které se látka mění z pevné látky na kapalnou.
- Bod varu: teplota, při které se látka mění z kapaliny na plyn.
- Elektrická vodivost: je měřítkem toho, jak dobře se elektrické proudy pohybují látkou.
- Tepelná vodivost: rychlost, kterou látka přenáší teplo.
- Zpevnitelnost: je schopnost látky být válcována nebo mleta různými způsoby.
- Lesk nebo lesk: je to, jak snadno objekt odráží světlo.
Chemické vlastnosti látky
Chemické vlastnosti popisují schopnost látky transformovat se na novou látku s různými vlastnostmi. Níže je uvedeno několik příkladů chemických vlastností:
- Teplo spalování: je energie uvolněná, když sloučenina prochází úplným spalováním kyslíkem.
- Chemická stabilita: označuje, zda sloučenina bude reagovat s vodou nebo vzduchem (chemicky stabilní látky nebudou reagovat).
- Hořlavost: schopnost sloučeniny spálit při vystavení plameni.
- Reaktivita: schopnost interakce s jinou látkou a vytvoření jedné nebo více nových látek.
Fyzikální stavy hmoty
Hmota je něco, co zabírá prostor, který má hmotu a které lze vnímat našimi smysly. Hmotu lze klasifikovat podle jejího fyzického stavu: pevné, kapalné a plynné.
1. Pevné látky a jejich charakteristické vlastnosti
Všechny pevné látky mají hmotnost, zabírají prostor, mají definovaný objem a tvar, neklouzají prostorem a nemohou být stlačovány nebo mají tuhou formu. Jako příklady máme: dřevo, knihy, houby, kov, kameny atd..
V pevných látkách jsou malé částice hmoty velmi blízko u sebe a dotýkají se. Částice jsou tak blízko u sebe, že se nemohou moc pohybovat, mezi nimi je jen velmi málo místa.
2- Kapaliny a jejich charakteristické vlastnosti
Všechny kapaliny mají hmotnost, zabírají prostor, mají definovaný objem, ale ne definovaný tvar (protože se přizpůsobují kontejneru, kde jsou), mohou být stlačeny do velmi malé míry a mohou sklouznout prostorem. Jako příklady máme: vodu, petrolej, olej atd..
V kapalinách jsou malé částice hmoty o něco dále od sebe, mezi nimi je více prostoru (ve srovnání s pevnými látkami) a navzájem se nedotýkají. Proto se částice mohou pohybovat mezi prostory, tlačit a srazit se s jinými částicemi, neustále měnit směr.
3 - Plyny a jejich charakteristické vlastnosti
Všechny plyny mají hmotnost, zabírají prostor, nemají definovaný objem nebo tvar, mohou být do značné míry stlačeny a mohou difundovat do prostoru. Jako příklady máme: vodík, kyslík, dusík, oxid uhličitý, pára atd..
V plynech jsou malé částice hmoty mnohem dále od sebe, mezi nimi je mnohem více prostoru (ve srovnání s kapalinami) a nedotýkají se navzájem. Částice mají maximální volnost pohybu, takže tlačí a kolidují s ostatními částicemi, které neustále mění směr.
Změny stavu hmoty
Hmota může být přeměněna z pevného stavu do kapalného stavu a naopak a z kapalného stavu do plynného stavu a naopak. Tato konverze má název změny stavu věci a děje se změnami teploty:
Fúze
Změna stavu materiálu z pevné látky na kapalinu zvýšením teploty. Když se pevná látka zahřeje, teplo způsobí, že částice budou silněji vibrovat.
Po dosažení bodu tání mají pevné částice dostatečnou kinetickou energii, aby překonaly energetické síly přitažlivosti, které je drží v pevných polohách, a zlomí se, aby vytvořily malé skupiny kapalných částic..
Var nebo odpařování
Změna stavu kapalné látky na plynné pomocí zvýšení teploty. Když se kapalná látka zahřívá, teplo způsobuje, že se částice pohybují ještě rychleji.
Po dosažení bodu varu mají kapalné částice dostatečnou kinetickou energii k překonání přitažlivých sil, které je drží v pevných polohách, a oddělují se na jednotlivé plynné částice..
Zmrazení nebo tuhnutí
Změna stavu kapalné látky na tuhou pomocí poklesu teploty. Když je kapalná látka ochlazena, její částice ztrácejí spoustu kinetické energie. Při dosažení bodu tuhnutí se částice zastaví a v pevné poloze se stanou pevnými částicemi.
Zkapalňování nebo kondenzace
Změna stavu plynné látky na kapalinu snížením teploty. Když je plynná látka ochlazena, její částice ztrácejí spoustu kinetické energie, což je způsobuje, že se navzájem přitahují k tekutým částicím.
Sublimace
Některé materiály se mění přímo ze svého pevného stavu do svého plynného stavu nebo naopak, aniž by procházely kapalným stavem. Když se tyto pevné látky zahřívají, jejich částice se pohybují tak rychle, že oddělují zcela tvorbu páry nebo plynu, a naopak, když proces probíhá z plynné na pevnou látku..
Odkazy
- De Podesta, M. Pochopení vlastností hmoty, 2. vydání. Velká Británie: Taylor & Francis.
- Goel A. Státy hmoty. Nové Dillí: Discovery nakladatelství.
- Moore J, Stanitski C. Molekulární věda, 5. vydání. Stamford: Cengage učení.
- Ramakrishna A. Povaha hmoty, 1. vydání. New Delhi: Goyal Brothers Prakashan.
- Reger D, Goode S, Ball D. Chemistry. Principy a praxe, 3. vydání. Kanada: Brooks / Cole, Cengage Learning.
- Shapere D. Matter (fyzika). Zdroj: accessscience.com.
- Singh L, Kaur M. Matter v našem okolí. Indie: Škola S. Chand.


